Принципы и способы дозирования лекарственных средств. Дозирование лекарственных средств. Фармакокинетика и фармакодинамика лекарственных средств
Читайте также
Форма выпуска лекарственного вещества во многом определяет его путь введения в организм. После поступления лекарственного вещества в организм одновременно начинаются два процесса:
Изменение концентрации лекарственного вещества во времени. Эти процессы количественно описывает фармакокинетика.
Взаимодействие лекарственного вещества с молекулярными мишенями действия в органах и тканях организма, определяющие терапевтический эффект и побочные реакции лекарственного средства. Эти вопросы изучает фармакодинамика.
Клиницисты должны быть знакомы с дозировкой и назначением лекарства, которое должно быть назначено, а также с последними достижениями. Эта работа была поддержана провинциальным бюро образования провинции Чжэцзян и Национальным фондом естественных наук Китая.
Авторы не сообщают о конфликте интересов в этой работе. Совместная комиссия Международные стандарты аккредитации для больниц. 5-е изд. Правильное дозирование артеметер-люмефантрина для лечения неосложненной малярии в сельской Танзании: имеют ли значение свойства и характеристики пациента?
Соотношение между фармакокинетикой и фармакодинамикой схематично представлено на схеме 1.4. Оба эти процесса играют важную роль в механизмах действия лекарственных веществ, без них развитие терапевтического эффекта невозможно. В реальных условиях четкой грани между фармакокинетическими и фармакодинамическими процессами нет. Нарушение любой составляющей приводит к изменению концентрации лекарственного вещества в месте действия и соответственно - к снижению эффективности терапии или повышению вероятности развития побочных реакций.
Предписывающие привычки ванкомицина в отделении неотложной помощи: правильно ли мы дозируем? Дозировка тинзапарина с поправкой на вес при беременности. Факторы, влияющие на концентрацию лекарственного средства в плазме. Терапевтический иммуноглобулин следует назначать клиническим исходом, а не массой тела у пациентов с ожирением.
Профилактическая антикоагуляция с эноксапарином: подкожный путь, подходящий для критически больных? Невесовая терапия эноксапарином подтерапевтическая терапия у пациентов с травмой. Снижение связанной с линезолидом тромбоцитопении путем корректировки дозы на основе факторов риска, таких как базальное количество тромбоцитов и масса тела. Первоначальная доза ванкомицина на основе массы тела и клиренса креатинина для минимизации уровня недостаточности корыта у взрослых японцев. Дозирование паракальцитола в зависимости от массы тела или тяжести гиперпаратиреоза: двойное слепое, многоцентровое рандомизированное исследование.
Таблица 1.7
Концентрация лекарственного вещества в плазме крови и месте действия, а также развитие терапевтических эффектов и побочных реакций определяется режимом дозирования лекарственного вещества.
Доза - количество лекарственного вещества на прием. Выделяют разовую, суточную и курсовые дозы. В разовых дозах обычно назначают препараты для экстренного вмешательства в жизнедеятельность организма. Действие этих лекарственных средств обычно проявляется достаточно быстро. В суточных дозах обычно назначают препараты, обладающие кумулятивным (накопительным) эффектом. При этом суточная доза может быть разделена на несколько приемов. В курсовых дозах обычно назначают препараты с отсроченным терапевтическим эффектом. Для некоторых препаратов такого типа эмпирически подобраны схемы введения, определяющие то количество лекарственного вещества, которое необходимо ввести в тот или иной день проводимой терапии.
Возраст и масса тела, скорректированная программа инициации варфарина для пациентов с ишемическим инсультом. Возрастная номограмма инициации варфарина с возрастом и весом для пациентов с ишемическим инсультом. Предложение для индивидуализированного режима дозирования изониазида с использованием лекарственного средства для пациентов с туберкулезом.
Эффект высотой и весом настроенной дозы интратекального гипербарического бупивакаина для планового кесарева сечения. Эффекты по высоте и весу скорректированной дозы местного анестетика для спинальной анестезии для планового кесарева сечения. Вес тела не предсказывает уровни анти-Ха после профилактики фиксированной дозы с эноксапарином после ортопедической хирургии.
Для определения доз лекарственных средств и оценки их безопасности обычно используют экспериментальный метод. С его помощью на подопытных животных в экспериментальной практике определяют эффективную, токсическую и летальную дозы.
Под эффективной понимают дозу, вызывающую определенный фармакологический эффект, например гипотензивный, противовоспалительный. Токсическая - это доза, приводящая к развитию токсических осложнений. Летальная - доза, приводящая к гибели подопытных животных. Эти дозы принято обозначать как ED (effective dose), TD (toxic dose) и LD (lethal dose).
Влияние экстремумов массы тела на фармакокинетику, фармакодинамику, безопасность и переносимость апикабана у здоровых лиц. Масса тела оказывает ограниченное влияние на безопасность, переносимость, фармакокинетику или фармакодинамику ривароксабана у здоровых людей. Успокаивает ли отношение против рака опухолевого фактора к увеличению массы тела к больным с болезнью Крона? Терапевтическое преимущество клопидогреля с низкой дозой у пациентов, перенесших операцию сонной артерии, связано с изменчивостью ответа тромбоцитов аденозиндифосфата и веса пациентов.
Чаще всего определяют EDP ED50, ED99, TDP TD50, TD99, LDJ, LD50, и LD99, то есть дозы, обусловившие эффект (например гибель) у 1; 50 и 99% исследуемых животных. Так, ED1 характеризует минимальную дозу, способную оказать фармакологический эффект, ED50 - дозу, вызывающую эффект у половины исследованных животных, ED99 - дозу, вызывающую эффект практически у всех животных.
Более высокие пациенты с массой тела на поддерживающей терапии клопидогрелем имеют более низкие концентрации активного метаболита, более низкие уровни ингибирования тромбоцитов и более высокие показатели бедных пациентов, чем пациенты с низкой массой тела.
Является самым распространенным лекарственным ингредиентом в Америке. Есть более 600 лекарств, которые содержат ацетаминофен, в том числе без рецепта и отпускаемых по рецепту лекарств. Ниже приведен список некоторых распространенных фирменных лекарств, некоторые из которых содержат ацетаминофен.
Следует отметить, что для одного и того же лекарственного вещества эффективная доза может отличаться в зависимости от того, какой эффект является желательным. Так, для взрослого человека эффективная доза ацетилсалициловой кислоты в качестве антитромботического средства составляет 0,075-0,5 г/сут, в качестве противоревматичекого средства - 3 г/сут.
Этот список не включает все лекарства, содержащие ацетаминофен. Некоторые марки, перечисленные ниже, также имеют продукты, которые не содержат ацетаминофен. Если у вас есть лекарство, которое не указано здесь, просто проверьте этикетку, чтобы узнать, содержит ли он ацетаминофен или попросит вашего поставщика медицинских услуг.
Некоторые распространенные лекарственные препараты с надписью, которые содержат ацетаминофен
Некоторые общие лекарственные средства, отпускаемые по рецепту, содержащие ацетаминофен
Рецептурные лекарства, которые входят в общую форму, могут перечислить ингредиенты вместо названия лекарственного средства. Ваш лейбл по рецепту может содержать список ингредиентов, фирменное наименование или и то, и другое.Отметим, что LD определяется только на животных. Для человека определены значения ED и для ряда лекарственных веществ - значения TD. Чем больше интервал между ED50 и TD50, тем более безопасным является его применение:
Если ED99
Если ED1
Если ED1>ТD1, то препарат токсичен.
Так, относительно безопасным считается
Применение НПВП, диуретиков, сердечных гликозидов и др. Применение противоопухолевых препаратов, нейролептиков и других практически всегда сопряжено с риском развития токсических осложнений (см. табл. 1.7).
Всегда читайте и следуйте этикетке и спрашивайте у своего поставщика медицинских услуг, есть ли у вас вопросы об ингредиентах вашего лекарства. Процесс любой терапии лучше всего ориентироваться на врача или медицинского работника с сообразительностью, надлежащей подготовкой и опытом. В эти дни медицинская марихуана все чаще рекомендуется и часто заменяется рецептурными препаратами, которые имеют серьезные побочные эффекты и вызывающие привыкание свойства. В некоторых случаях, таких как эпилепсия и другие неврологические, никакое другое лекарство не обеспечивает хорошего качества жизни.
Эксперименты на животных не позволяют выявить все возможные терапевтические и побочные реакции. Особенно это касается кумулятивных эффектов и эффектов пролонгированного применения препаратов. В этих условиях также трудно определить реальное тератогенное и мутагенное действие. Поэтому после испытания новых лекарственных веществ на животных их исследуют на людях - и лишь затем разрешают для применения.
В настоящее время лекарства от каннабиса обычно используются вместе с другими лекарственными средствами для борьбы с болью, воспалением, беспокойством и другими симптомами. Широкая общественность и многие врачи до сих пор не знают, что лекарства от каннабиса могут эффективно доставляться пациентам практически любым способом. Астматики, например, могут теперь вдыхать лекарство каннабиса с помощью пузырьков, что, конечно же, является своего рода испарителем На самом деле, курить сустава может скоро стать наименее распространенным методом доз медицинской марихуаны.
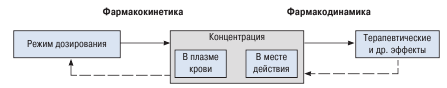
Схема 1.4.
При изучении действия лекарственных препаратов на здоровых добровольцах определяют минимальную терапевтическую и минимальную токсическую дозы. Минимальная терапевтическая доза (аналог ED1) определяется минимальным количеством лекарственного вещества, которое необходимо ввести для получения терапевтического эффекта. Минимальная токсическая доза (аналог ТD1) определяется минимальным количеством лекарственного вещества, при котором начинается развитие нежелательных, побочных или токсических явлений. Диапазон между минимальной токсической и терапевтической дозой называется терапевтическим диапазоном. Чем шире терапевтический диапазон, тем меньше вероятности возникновения осложнений при применении данного лекарственного вещества. Минимальная терапевтическая и минимальная токсическая доза лекарственного вещества во многом определяется путем введения лекарственного вещества в организм. Поэтому оптимизация фармакологической терапии может быть сведена к поддержанию концентрации лекарственного вещества в заданной ткани в пределах терапевтического диапазона. Это позволит достигнуть лечебного эффекта без развития побочного действия. Поскольку в большинстве случаев выявить концентрацию лекарственного вещества в месте его действия (в точке приложения) не представляется возможным, чаще всего на практике определяют концентрацию в плазме крови, поскольку именно концентрация лекарственного вещества в плазме крови определяет его системное действие: поступление в органы мишени и развитие побочных реакций. Поэтому оптимизация лечения с целью повышения эффективности терапии и снижения риска развития побочных реакций может быть сведена к определению концентрации лекарственного вещества в плазме крови либо в других биологических средах организма человека.
Пути введения лекарств на основе каннабиса. Вдыхание Устные актуальные сублингвальные инъекции. . Эта схема дозирования лекарственного средства не является уникальной для каннабиса. Рекомендуется рекомендованная пациентом модель для самостоятельной дозировки. Эта модель самонаведения приемлема с учетом переменных, влияющих на администрацию, а также низкой токсичности каннабиса. Многие другие препараты обладают относительно низкой токсичностью и высокими потоками дозирования и обычно эффективно титруются.
Вдыхание; опытный курильщик каннабиса может титровать и регулировать дозу для получения желаемых острых эффектов и минимизации нежелательных эффектов. Каждая затяжка доставляет дискретную дозу каннабиноидов в организм. Изменение объема и объема ингаляции с фазой курения, как правило, является наивысшей в начале и самой низкой в конце курения сигареты.
Следовательно, режим дозирования лекарственного вещества должен быть подобран так, чтобы концентрация лекарственного вещества в плазме крови была в пределах терапевтического диапазона. Закономерности изменения концентрации лекарственных веществ в организме изучает фармакокинетика. Теоретическая часть этой науки основана на математических методах анализа процессов изменения концентрации лекарственных веществ в организме. Клиническая фармакокинетика базируется на терапевтическом лекарственном мониторинге (therapeutic drug monitoring, ТЛМ) - определении концентрации лекарственных веществ в биологических тканях и жидкостях, что позволяет рационально подбирать индивидуальный режим применения лекарственного средства у больного для достижения максимального терапевтического эффекта и безопасности.
Начало действия задерживается, а титрование дозировки является более сложным. Традиционно высушенные цветы каннабиса или листья курят. Концентрированная жирная марихуана Хеш и ковер также используются во всем современном и древнем мире. Вдыхаемые лекарства, как правило, очень быстро всасываются и действуют как локально, так и систематически через несколько минут. Для контроля количества дозы необходима правильная техника с использованием ингаляционных устройств. Некоторые лекарства могут иметь неприятный вкус или вызвать раздражение во рту.
Клиническая фармакокинетика основана на существовании взаимосвязи между доступной определению концентрацией лекарственного средства (например в плазме крови или цельной крови) и его эффектами (терапевтическими или побочными). Для многих лекарств это действительно справедливо, но в некоторых случаях выявить такую взаимосвязь не удается. Как правило, концентрация лекарственного средства в крови связана с его концентрацией в ткани-мишени. Клиническая фармакокинетика позволяет количественно оценить зависимость эффекта от дозы и интерпретировать данные о динамике концентрации лекарственного средства в биологических жидкостях. Выбор и коррекция схемы лечения с учетом фармакокинетических закономерностей позволяет повысить эффективность и безопасность медикаментозного лечения.
Вдыхание доставляет лекарственные препараты в нервную систему и головной мозг с небольшим разбавлением системой кровообращения. Вдыхание психоактивного вещества может вызвать зависимость у некоторых людей. Несмотря на это, марихуана занимает самое низкое место в аддиктивных свойствах, намного ниже, чем алкоголь, кокаин, героин, никотин или даже кофеин.
Рекомендуемая практика: использование вапков с правильным концентратом обеспечит превосходные преимущества без ощутимого запаха или послевкусия. Эффекты: начинается через несколько минут и длится около двух часов плюс или минус. Подождите несколько минут. и принять еще 2 мг «хит», если ваши симптомы все еще присутствуют. Когда вы узнаете о своем ответе, сразу же можно использовать больше лекарств, а затем добавить оттуда.
Необходимость изменить дозу при тех или иных физиологических и патологических состояниях зачастую обусловлена изменением фармакокинетики препарата. К наиболее важным фармакокинетическим параметрам относятся клиренс, характеризующий элиминацию препарата, объем распределения - кажущийся объем, в котором содержится лекарственное вещество, период полувыведения (Ту) - параметр, характеризующий скорость выведения препарата из организма, и биодоступность - доля введенного препарата, поступившая в системный кровоток. Менее значимые параметры - скорость всасывания и скорость распределения.
Разогреть испаритель до температуры, рекомендованной производителем. Вставьте измеренное количество высушенного цветка или экстракта каннабиса в испаритель. Нажмите кнопку включения, а затем просто вдохните. Каннабис нагревают до температуры ниже сгорания, но до сих пор достаточно горячим, чтобы выделять активные ингредиенты: каннабиноиды и терпены. Пары могут быть настолько чистыми, что пользователь иногда думает, что они никогда «ничего не получили»: новичков можно легко обмануть в чрезмерное медикаментозное лечение и ждать 10 минут до повторного дозирования.
Клиренс лекарственного вещества
Это важнейший фармакокинетический параметр, позволяющий подобрать дозовый режим при длительном лечении. Чтобы обеспечить необходимый терапевтический эффект и свести к минимуму риск побочного действия, средняя концентрация препарата в сыворотке крови в стационарном состоянии должна находиться в пределах терапевтического диапазона. Если биодоступность составляет 100%, в стационарном состоянии скорость элиминации препарата равна скорости его поступления.
Для большинства пациентов последствия курения сушеных каннабиса ощущаются почти сразу, но вскоре начинают уменьшаться. В зависимости от конкретного пациента, а также содержания каннабиноидов и потенции штамма каннабиса, эффекты почти полностью исчезают в течение 90 минут до 4 часов.
Будет ли курение или тряпка заставлять меня пахнуть, как горшок? В наши дни большинство пациентов используют вену с хорошим продуктом каннабиса, который производит незначительные запахи. Дым из марихуаны может быть вреден для легких, но только в больших, оскорбительных - немедицинских количествах. При умеренном применении, один или два сустава в день, воздействие на легкие представляется незначительным или даже терапевтическим.
Скорость поступления = Cl х Ссредн (1.1)
Где скорость поступления - количество введенного препарата в единицу времени, С1 - суммарный клиренс, а Ссредн - средняя концентрация препарата в сыворотке крови в стационарном состоянии. Если известна требуемая средняя концентрация препарата в сыворотке крови, скорость поступления можно рассчитать по клиренсу.
В медицине и отравлении в то же время мало смысла. Плесень, пестициды и остаточные растворители являются серьезными загрязнителями, которые часто встречаются при случайном тестировании. При использовании любого вида лекарств каннабиса в продуктах не должно быть остаточных растворителей, пестицидов, гербицидов, тяжелых металлов, плесени, грибков и других токсичных компонентов.
Красота лекарств на основе каннабиса заключается в том, что их токсичность и побочные эффекты намного ниже, чем ваш стандартный фармацевтический препарат. Побочные эффекты ограничены незначительными жалобами. Преимущества: Легко снимается, длительный, успокаивающий и гладкий.
Важнейшая с клинической точки зрения особенность клиренса - он, как правило, не зависит от концентрации препарата. Дело в том, что системы, отвечающие за элиминацию большинства лекарственных средств (ферментные, транспортные), обычно не насыщаются, и абсолютная скорость элиминации линейно зависит от концентрации препарата в сыворотке крови. Иными словами, элиминация подчиняется кинетике первого порядка - доля препарата, удаляемая за единицу времени, постоянна. Если же системы элиминации насыщаются, постоянна не доля, а количество препарата, удаляемого за единицу времени. При этом элиминация подчиняется кинетике нулевого порядка, а клиренс зависит от концентрации препарата в сыворотке крови:?
Таким образом, сырые и печеные могут доставлять непсихотические или психоактивные эффекты соответственно. Недостатки: Горький, неприятный вкус для некоторых неба. Побочные эффекты: употребление слишком большого количества медикаментозного каннабиса может вызвать сильную сонливость, головокружение, неспособность сосредоточиться, уменьшенную способность фокусироваться, быстрое сердцебиение, увеличение или уменьшение артериального давления, потребность во сне и чувства эйфории.
Уильям Кортни, гуру славы сока, рекомендует ежедневно проглатывать пятнадцать листьев и несколько больших почек. Устный маршрут, как правило, самый удобный и самый дешевый из систем доставки лекарств. В большинстве случаев медицинская марихуана имеет тенденцию успокаивать и балансировать кишечный тракт, особенно толстую кишку, можно было резко снизить воспаление, как видно из многих документированных случаев болезни Крона. Однако препараты, включая марихуану, могут вызывать раздражение желудочно-кишечного тракта в некоторых.
С1 = Vm / (Кm + С), (1.2)
Где Кm - концентрация препарата, при которой скорость элиминации составляет половину от максимальной, а Vm - максимальная скорость элиминации, С - концентрация препарата в сыворотке крови.
Понятие клиренса лекарственного средства аналогично понятию клиренса в физиологии почек. Так, клиренс креатинина равен отношению скорости экскреции креатинина с мочой к концентрации креатинина в плазме крови. В общем случае клиренс лекарственного средства равен отношению скорости элиминации вещества всеми органами к концентрации препарата в биологической жидкости.
С1 = скорость элиминации / С. (1.3)
Если клиренс постоянный, скорость элиминации прямо пропорциональна концентрации лекарственного средства. Клиренс отражает не количество элиминировавшегося препарата, а объем биологической жидкости (плазма крови или цельная кровь), полностью очищающийся от данного вещества за единицу времени. Этот показатель можно рассчитать для плазмы крови или цельной крови, а также определить клиренс свободного препарата.
Элиминация лекарственных средств осуществляется почками, печенью и другими органами. Рассчитав клирес для каждого органа как отношение скорости элиминации данным органом к концентрации препарата (например в плазме крови) и просуммировав клиренсы для всех органов, получим суммарный клиренс.
С1поч + С1печ + С1пр = С1, (1.4)
Где С1поч - почечный клиренс, С1печ - печеночный клиренс, С1пр - клиренс для прочих органов (лекарственные средства могут метаболизироваться в других органах, выводятся с калом, потом, слюной).
В стационарном состоянии суммарный клиренс можно определить с помощью уравнения 1.1. При однократном введении препарата, биодоступность которого равна 100%, а элиминация подчиняется кинетике первого порядка, суммарный клиренс можно рассчитать на основании закона сохранения массы и интегрирования уравнения 1.3 по времени.
С1 = Доза / AUС. (1.5)
Например. Клиренс пропранолола (для цельной крови) составляет 16 мл/мин/кг (1120 мл/мин при массе тела 70 кг). Препарат элиминируется преимущественно печенью, то есть за 1 мин печень очищает от пропранолола 1120 мл крови. Клиренс не всегда соответствует плазмотоку (или кровотоку) через орган, отвечающий за элиминацию. Если препарат связывается с эритроцитами, скорость его доставки в этот орган существенно выше, чем можно предположить исходя из концентрации препарата в плазме крови. В стационарном состоянии клиренс для плазмы крови и цельной крови выглядит следующим образом:
С1n / С1k = Сk / Сn = 1 + Ht x [Сэ / Сn -1], (1.6)
Где С1n - клиренс для плазмы крови, С1k - клиренс для цельной крови, Сn - концентрация препарата в плазме крови, Ск - концентрация препарата в цельной крови, Сэ - концентрация препарата в эритроцитах, Ht - гематокрит.
Таким образом, клиренс для цельной крови равен частному от деления клиренса для плазмы крови на отношение концентраций препарата в цельной крови и плазме крови.
Распределение
Объем распределения
Этот второй важнейший фармакокинетический параметр характеризует распределение препарата в организме. Объем распределения (V) равен отношению общего содержания вещества в организме (ОСО) к его концентрации (С) в плазме крови или цельной крови. Объем распределения часто не соответствует никакому реальному объему. Этот объем, необходимый для равномерного распределения вещества в концентрации, равной концентрации этого вещества в плазме крови или цельной крови.
Vp = ОСО / С. (1.7)
Объем распределения отражает долю вещества, содержащегося во внесосудистом пространстве. У человека массой тела 70 кг объем плазмы крови составляет 3 л, ОЦК - около 5,5 л, межклеточной жидкости - 12 л, общее содержание воды в организме - примерно 42 л. Однако объем распределения многих лекарственных веществ гораздо больше этих величин. Например, если у человека массой тела 70 кг в организме содержится 500 мкг дигоксина, его концентрация в плазме крови составляет 0,75 нг/мл. Разделив общее содержание дигоксина в организме на его концентрацию в плазме крови, получим, что объем распределения дигоксина равен 650 л. Это более чем в 10 раз превышает общее содержание воды в организме. Дело в том, что дигоксин распределяется преимущественно в миокарде, скелетных мышцах и жировой ткани, так что его содержание в плазме крови невелико. Объем распределения лекарственных средств, активно связывающихся с белками плазмы крови (но не с компонентами тканей), примерно соответствуют объему плазмы крови. Вместе с тем некоторые лекарственные средства содержатся в плазме крови преимущественно в связанной с альбумином форме, но имеют большой объем распределения за счет депонирования в других тканях.
Период полувыведения
Период полувыведения (Т1/2) - это время, за которое концентрация вещества в сыворотке крови (или его общее содержание в организме) снижается вдвое. В рамках однокамерной модели определить Т1/2 очень просто. Полученное значение используют затем для расчета дозы. Однако для многих лекарственных средств приходится использовать многокамерную модель, поскольку динамика их концентрации в сыворотке крови описывается несколькими экспоненциальными функциями. В таких случаях рассчитывают несколько значений Т1/2.
В настоящее время общепризнано, что Ти зависит от клиренса и объема распределения вещества. В стационарном состоянии зависимость между Ти, клиренсом и объемом распределения вещества приблизительно описывается следующим уравнением:
T1/2 « 0,693 х Vp / Cl. (1.8)
Клиренс характеризует способность организма элиминировать вещество, поэтому при снижении этого показателя вследствие какого-либо заболевания Т1/2 увеличивается. Но это справедливо лишь в том случае, если не меняется объем распределения вещества. Например, с возрастом Т диазепама увеличивается, но не за счет снижения клиренса, а вследствие увеличения объема распределения (Klotzet et al., 1975). На клиренс и объем распределения влияет степень связывания вещества с белками плазмы крови и тканей, так что прогнозировать изменение Т1/2 при том или ином патологическом состоянии не всегда возможно.
По Т1/2 не всегда можно судить об изменении элиминации препарата, зато этот показатель позволяет рассчитать время достижения стационарного состояния (в начале лечения, а также при изменении дозы или частоты введения). Концентрация лекарственного вещества в сыворотке крови, составляющая примерно 94% средней стационарной, достигается за время, равное 4 х Т1/2. Кроме того, с помощью Т1/2 можно оценить время, необходимое для полной элиминации вещества из организма, и рассчитать интервал между введениями.
Биодоступность и скорость всасывания
Биодоступность
Как выше отмечено, в системный кровоток поступает не весь всосавшийся препарат. Количество лекарственного средства, поступившее в системный кровоток, зависит не только от дозы, но и от биодоступности. Последняя определяется степенью всасывания, а также степенью элиминации, которой лекарственное средство подвергается до поступления в системный кровоток. Помимо неполного всасывания (см. выше), низкая биодоступность может быть обусловлена интенсивным метаболизмом в кишечнике или печени либо экскрецией с желчью.
Скорость всасывания
Скорость всасывания, как правило, не влияет на среднюю концентрацию препарата в сыворотке крови в стационарном состоянии, но может существенно сказываться на фармакологических эффектах. Если препарат поступает в системный кровоток быстро (например при внутривенном струйном введении) и первоначально распределяется в небольшом объеме, концентрация его в сыворотке крови может быть достаточно высокой. По мере распределения препарата в менее интенсивно кровоснабжаемые органы и ткани она снижается. Если препарат поступает в системный кровоток медленнее (например при внутривенной инфузии), его распределение начинается еще до того, как будет введена вся доза. Поэтому максимальная концентрация в сыворотке крови ниже и достигается позднее. Препараты длительного действия обеспечивают медленное, равномерное всасывания лекарственных средств, снижая колебания концентрации препарата в сыворотке крови в период между введениями. Скорость распределения лекарственного вещества в разные ткани-мишени может быть разной, поэтому при изменении скорости введения выраженность терапевтических эффектов и побочных реакций может временно меняться.
Подбор и коррекция дозы
Терапевтический эффект при однократном введении препарата появляется спустя некоторое время после введения, постепенно достигается максимума, затем ослабевает и исчезает.
Его динамика соответствует концентрации препарата в сыворотке крови, что определяется его фармакологическими особенностями (всасывание, распределение, элиминация). Терапевтический эффект появляется по достижении терапевтической концентрации и возрастает по мере ее повышения. Длительность эффекта зависит от времени, в течение которого концентрация препарата в сыворотке крови превышает терапевтическую. Аналогичным образом побочные реакции зависят от токсической концентрации препарата. В диапазоне между этими концентрациями (терапевтический диапазон) лекарственное средство эффективно, но не оказывает побочных реакций. При многократном введении препарата дозу и интервал между введениями подбирают таким образом, чтобы достичь максимального терапевтического эффекта при минимальном побочном действии. Нижней границей терапевтического диапазона, как правило, считают концентрацию препарата в сыворотке крови, при которой терапевтический эффект составляет примерно половину максимального. Верхняя же граница соответствует концентрации, в которой побочные реакции возникают не более чем у 5-10% больных. Токсическая концентрация некоторых лекарственных средств превышает терапевтическую менее чем в 2 раза. Следует помнить и об индивидуальных особенностях пациентов: одни хорошо переносят концентрацию препарата в сыворотке крови, превышающую токсическую, а у других возникают выраженные побочные реакции, когда концентрация в сыворотке крови остается в пределах терапевтического диапазона.
Если фармакологические эффекты лекарственных средств оценивать легко (например по изменению АД или уровню глюкозы плазмы крови), то дозу можно подбирать методом проб и ошибок. Чтобы определить, в каких пределах и насколько часто можно менять дозу, применяют эмпирические правила, учитывающие вышеприведенные фармакологические закономерности (например, дозу меняют не более чем на 50% и не чаще чем через 3-4 Ти). Если дозозависимой токсичности нет, для обеспечения максимальной эффективности и увеличения времени действия препарата можно применять его в дозе значительно выше средней терапевтической. Так, например, поступают с большинством блокаторов р-адренорецепторов.
Если фармакологические эффекты оценить тяжело, лекарственное средство обладает узким терапевтическим диапазоном, высокий риск побочных реакций при неэффективности лечения или препарат применяют с профилактической целью, дозу меняют незначительно, тщательно наблюдая больных для выявления побочных реакций. Так или иначе средняя концентрация лекарственного средства в стационарном состоянии должна находиться в пределах терапевтического диапазона. В большинстве случаев определять фактическую концентрацию препарата в сыворотке крови нет необходимости: достаточно лишь знать, как она зависит от дозы и частоты введения. Однако для небольшого количества препаратов терапевтическая концентрация отличается от токсической всего в 2-3 раза (дигоксин, теофиллин, лидокаин, аминогликозиды, циклоспорины, противосудорожные средства) в стационарном состоянии, в которой он эффективен, но обусловливает минимум побочных реакций. Затем измеряют фактическую концентрацию препарата и при необходимости корригируют дозу так, чтобы фактическая концентрация была максимально приближена к требуемой.
Поддерживающая доза
В большинстве случаев лекарственные средства вводят дробно или в виде инфузии так, чтобы стационарная концентрация находилась в пределах терапевтического диапазона. В стационарном состоянии скорость поступления препарата равна скорости его элиминации. Подставив в уравнение требуемую концентрацию препарата в сыворотке крови, получим:
Скорость поступления = Ссредн * С1 / F, (1.9)
Где F - биодоступность.
Зная требуемую сывороточную концентрацию препарата, его клиренс и биодоступность, можно рассчитать дозу и частоту введения.
Дозу и частоту приема (то есть скорость поступления препарата) можно рассчитать на основании уравнения 1.9. Биодоступность дигоксина равна 0,7.
Скорость поступления = С средн, * С1 / F = 1,5 нг/мл * 1,6 / 0,7 мл/мин/кг = 3,43 нг/кг/мин = 236 нг/мин = 236 * 60 * 24 / 1000 мкг/сут = 340мкг/сут = 0,34 мг/сут.
На практике дозу округляют до ближайшей стандартной, например до 375 мкг/сут или до 0,25 мг/сут. В первом случае средняя концентрация в плазме крови в стационарном состоянии составит 1,5 х 375 / 340 = 1,65 нг/мл, во втором - 1,5 х 250 / 340 = 1,1 нг/мл. ?
Интервал между введениями
Желательно, чтобы в промежутке между введениями не было резких колебаний концентрации препарата в сыворотке крови. Если бы всасывание и распределение препарата происходили мгновенно, размах этих колебаний зависел бы только от Ти. Когда интервал между введениями равен Ти, минимальная и максимальная концентрация различаются в 2 раза, что вполне допустимо.
Если терапевтический диапазон лекарственного средства достаточно широк, то есть в концентрациях, значительно превышающих терапевтическую, оно переносится хорошо, можно назначать максимальные дозы. В данном случае интервал между введениями может быть намного больше Ти, что очень удобно для больного.
Для лекарственного средства с узким терапевтическим диапазоном нередко приходится измерять максимальную и минимальную концентрации препарата в сыворотке крови. Минимальную концентрацию в стационарном состоянии (Смин) дигоксина рассчитывают по следующему уравнению:
Где к = 0,693 / Ту, а Т - интервал между введениями. Величина е-кТ представляет собою долю предыдущей дозы, оставшуюся в организме к моменту введения следующей дозы (с учетом биодоступности).
Насыщающую дозу можно принимать внутрь или вводить внутривенно. Чтобы снизить риск побочных реакций, ее дробят. Вначале вводят 0,5 мг, через 6-8 ч - еще 0,25 мг, тщательно наблюдая больного. Последние 0,25 мг при необходимости тоже можно разделить на 2 дозы по 0,125 мг и вводить с интервалом 6-8 ч, особенно если на прием дигоксина в поддерживающий дозе планируется перейти в течение 24 ч с момента начала лечения.
Индивидуальный подбор дозы
Схему лечения определяют на основании закономерностей всасывания, распределение и элиминации препарата и фармакокинетических параметров С1, Ур, и Т1/2). Рекомендуемые схемы обычно рассчитаны на «среднего» больного. Для многих лекарственных средств стандартное отклонение таких параметров, как F, С1, и Ур, составляет соответственно 20; 50 и 30%. Иными словами, в 95% случаев концентрация препарата в сыворотке крови в стационарном состоянии находится в пределах от 35 до 270% требуемой, что неприемлемо для препаратов с узким терапевтическим диапазоном. Поэтому индивидуальныйподбор дозы и частоты введения - важнейшее условие эффективности лечения. Основываясь на вышеописанных фармакологических закономерностях, схему лечения подбирают таким образом, чтобы обеспечить необходимый терапевтический эффект и свести к минимуму риск побочных реакций. По возможности измеряют концентрацию лекарственных средств в сыворотке крови. На основании полученных данных по специальным методикам корригируют дозу препаратов с узким терапевтическим диапазоном (например сердечных гликозидов, антиаритмических средств, дифенина, теофиллина).
Количественные и качественные методы фармакокинетики сложны и дорогостоящи для обычного применения, которое к тому же во многих случаях не оправдано, так как существуют отработанные схемы дозирования лекарственных средств и их коррекции с учетом индивидуальных особенностей пациентов. Однако в ряде случаев для этого необходим терапевтический лекарственный мониторинг, который обязателен в следующих ситуациях, к которым в первую очередь относятся (Белоусов Ю.Б., Гуревич К.Г., 2005):
1. Значительная индивидуальная вариация фармакокинетических параметров препаратов. Например, известны случаи, когда лечебный эффект препарата в плазме крови достигался при минимальной терапевтической концентрации. Так, острые гепатотоксические эффекты в результате применения парацетамола были отмечены в плазме крови в соответствии с терапевтическим коридором, а другие факторы, которые могли бы привести к подобному осложнению (например алкоголизм), были исключены.
2. Особенности фармакокинетики у детей и лиц пожилого возраста. У первых отмечают существенные вариации в развитии систем метаболизма и экскреции лекарственного вещества. Практически у всех лиц пожилого возраста выявляют заболевания, изменяющие фармакокинетические параметры известных лекарственных препаратов или требующие комплексной терапии, при которой могут возникнуть непредсказуемые лекарственные взаимодействия. Кроме того, с возрастом даже у лиц без заболевания почек отмечается снижение почечного клиренса креатинина, что характеризует снижение эффективности системы элиминации лекарственных средств.
3. Узкий терапевтический диапазон лекарственного препарата, высокая вероятность развития побочных реакций даже при использовании минимальных терапевтических концентраций лекарственного вещества.
4. Период беременности, кормления грудью и прочие состояния, при которых необходимо полностью исключить риск развития побочных реакций лекарственной терапии, или ситуации, при которых существенно изменяются фармакокинетические параметры препаратов.
5. Нелинейная фармакокинетика препаратов, когда нет четкой связи между концентрацией лекарственного вещества в крови и терапевтическим эффектом. При этом обычно постулируется, что развитие побочных реакций связано с изменением концентрации лекарственного вещества в плазме крови или эффекторной ткани.
6. Заболевания, изменяющие фармакокинетические параметры лекарственных препаратов: СН, печеночная и почечная недостаточность, заболевание ЖКТ.
7. Необходимость проведения комплексного лечения, непредсказуемость эффектов сочетанной фармакотерапии. При этом следует учитывать прием пациентом безрецептурных препаратов, растительных компонентов, а также характер питания. Обычно терапевтический лекарственный мониторинг необходим при одновременном применении >5 лекарственных средств, включая лекарственные формы для местного применения, витаминные средства, гормональные контрацептивы, средства народной медицины, гомеопатические субстанции и т.д. Однако при назначении сильнодействующих или имеющих одинаковые системы метаболизма препаратов либо во всех указанных в п. 1-6 случаях терапевтический лекарственный мониторинг может потребоваться уже при применении >2 лекарственных средств.
Действие ЛС на организм в большей степени определяется их дозой.
Доза - количество вещества, введенное в организм за один прием; выражается в весовых, объемных или условных (биологических) единицах.
Виды доз:
а) разовая доза – количество вещества на один прием
б) суточная доза - количество препарата, назначаемое на сутки в один или несколько приемов
в) курсовая доза - общее количество препарата на курс лечения
г) терапевтические дозы - дозы, в которых препарат используют с лечебными или профилактическими целями (пороговые, или минимальные действующие, средние терапевтические и высшие терапевтические дозы).
д) токсические и смертельные дозы – дозы ЛВ, при которых они начинают оказывать выраженные токсические эффекты или вызывать смерть организма.
е) загрузочная (вводная) доза – кол-во вводимого ЛС, которое заполняет весь объем распределения организма в действующей (терапевтической) концентрации: ВД = (Css * Vd)/F
ж) поддерживающая доза – систематически вводимое количество ЛС, которое компенсирует потери ЛС с клиренсом: ПД = (Css * Cl * T)/F
Единицы дозирования ЛС:
1) в граммах или долях грамма ЛС
2) количество ЛС в расчете на 1 кг массы тела (например, 1 мг/кг ) или на единицу поверхности тела (например, 1 мг/м 2 )
Цели дозирования ЛС:
1) определить количество ЛС, необходимое для того, чтобы вызвать нужный терапевтический эффект с определенной длительностью
2) избежать явлений интоксикации и побочных эффектов при введении ЛС
Способы введения ЛС : 1) энтерально 2) парентерально (см. в. 5)
Варианты введения ЛС :
а) непрерывный (путем длительных внутрисосудистых инфузий ЛС капельно или через автоматические дозаторы). При непрерывном введении ЛС его концентрация в организме изменяется плавно и не подвергается значительным колебаниям
б) прерывистое введение (инъекционным или неинъекционным способами) - введение лекарства через определенные промежутки времени (интервалы дозирования). При прерывистом введении ЛС его концентрация в организме непрерывно колеблется. После приема определенной дозы она вначале повышается, а затем постепенно снижается, достигая минимальных значений перед очередным введением лекарства. Колебания концентрации тем значительнее, чем больше вводимая доза лекарства и интервал между введениями.
Интервал введения – интервал между вводимыми дозами, обеспечивающий поддержание терапевтической концентрации вещества в крови.
16. Введение лекарств с постоянной скоростью. Кинетика концентрации препарата в крови. Стационарная концентрация препарата в крови (Css), время ее достижения, расчет и управление ею.
Особенность введения ЛС с постоянной скоростью - плавное изменение его концентрации в крови при введении, при этом:
1) время достижения стационарной концентрации лекарства составляет 4-5t ½ и не зависит от скорости инфузии (величины вводимой дозы)
2) при увеличении скорости инфузии (вводимой дозы) величина С SS также увеличивается в пропорциональное число раз
3) элиминация лекарства из организма после прекращения инфузии занимает 4-5t ½ .
С ss – равновесная стационарная концентрация – концентрация ЛС, достигаемая при скорости введения равной скорости выведения, поэтому:
 (из
определения клиренса)
(из
определения клиренса)
За каждый последующий период полувыведения концентрация ЛС прирастает на половину от оставшейся концентрации. Все ЛС, подчиняющиеся закону элиминации первого порядка, будут достигать Css через 4-5 периодов полувыведения.
Подходы к управлению уровнем С ss : изменить вводимую дозу ЛС или интервал введения
17. Прерывистое введение лекарств. Кинетика концентрации препарата в крови, терапевтический и токсический диапазон концентраций. Расчет стационарной концентрации (C ss ), границ ее колебаний и управление ею. Адекватный интервал введения дискретных доз.
К олебания
концентрации ЛС в плазме крови:1
- при постоянном внутривенном капельном
введении;
2 -при дробном введении той же суточной
дозы с интервалом 8 ч;3 - при введении
суточной дозы с интервалом
24 ч.
олебания
концентрации ЛС в плазме крови:1
- при постоянном внутривенном капельном
введении;
2 -при дробном введении той же суточной
дозы с интервалом 8 ч;3 - при введении
суточной дозы с интервалом
24 ч.
Прерывистое введение ЛС – введение определенного количества ЛС через некоторые промежутки времени.
Равновесная стационарная концентрация достигается через 4-5 периодов полуэлиминации, время ее достижения не зависит от дозы (в начале, когда уровень концентрации ЛС невысок, скорость его элиминации также невысока; по мере увеличения количества вещества в организме нарастает и скорость его элиминации, поэтому рано или поздно наступит такой момент, когда возросшая скорость элиминации уравновесит вводимую дозу ЛС и дальнейший рост концентрации прекратиться)
 ,Css
прямо пропорциональна дозе ЛС и обратно
пропорциональна интервалу введения и
клиренсу ЛС.
,Css
прямо пропорциональна дозе ЛС и обратно
пропорциональна интервалу введения и
клиренсу ЛС.
Границы
колебаний Css:
 ;
C ss min
= C ss max
× (1 – эл. фр.).
Колебания концентрации ЛС пропорциональны
;
C ss min
= C ss max
× (1 – эл. фр.).
Колебания концентрации ЛС пропорциональны
 T/t 1/2 .
T/t 1/2 .
Терапевтический диапазон (коридор безопасности, терапевтическое окно) – это интервал концентраций от минимальной терапевтической до вызывающей появление первых признаков побочных действий.
Токсический диапазон – интервал концентрации от высшей терапевтической до смертельной.
Адекватный режим введения дискретных доз : такой режим введения, при котором флюктуация концентрации препарата в крови укладывается в терапевтический диапазон. Для определения адекватного режима введения ЛС необходимо рассчитать. Разница между Css max и Css min при этом не должна превысить 2Css.
Управление колебаниями Css :
Размах колебаний Css прямо пропорционален дозе ЛС и обратно пропорционален интервалу его введения.
1. Изменить дозу ЛС : при увеличении дозы ЛС диапазон колебаний его Css пропорционально увеличивается
2. Изменить интервал введения ЛС : при увеличении интервала введения ЛС диапазон колебаний его Css пропорционально уменьшается
3. Одновременно изменить дозу и интервал введения