Лимфоидные клетки слизистой оболочки, их функция. Иммунология: новообразования лимфоидной системы Лимфома из клеток мантийной зоны
Читайте также
В пределах собственной пластинки слизистой оболочки расположены, главным образом, плазматические клетки . Большинство этих клеток, обнаруживаемых при рождении, содержат IgM с небольшим количеством IgG или IgA. После того, как индивидуум становится способным отвечать на антигены окружающей среды (это происходит приблизительно к двухлетнему возрасту), в lamina propria в основном обнаруживаются плазматические клетки, содержащие IgA. Такая же картина наблюдается и у взрослых. Известно, что кишечная флора является очень важным фактором, стимулирующим продукцию плазматическими клетками IgA. Это подтверждается пониженным содержанием плазматических клеток в lamina propria у животных, которых выращивали в безмикробной среде.
Лимфоциты в слизистой оболочке имеют специализированные функции и локализуются в специфических участках. В пределах эпителиального слоя они находятся между эпителиальными клетками и получили название интраэпителиальных лимфоцитов (ИЭЛ; по некоторым авторам -интерэпителиальные).
Интраэпителиальные Т-лимфоциты фенотипически и функционально отличаются от Т-лимфоцитов периферической крови. Почти все ИЭЛ имеют на своей поверхности антиген 1 лимфоцитов слизистых оболочек человека (HML-1 -human mucosal lymphocyte antigen 1), которого нет на Т-лимфоцитах периферической крови. Среди интраэпителиальных Т-лимфоцитов большинство клеток имеет CD8 маркер (75%) и только 6% - CD4 маркер. Часть интраэпителиальных Т-лимфоцитов относится к гамма-, дельта- Т-лимфоцитам (подробней о γδ Т-лимфоцитах сказано в конце главы).
В собственной пластинке слизистой оболочки помимо плазматических клеток и Т-лимфоцитов обнаружены также В-лимфоциты, ЕК-клетки, тканевые базофилы и макрофаги. Количество Т-клеток в 4 раза больше, чем В-клеток. Среди Т-клеток lamina propria, в противоположность интраэпителиальным, 80% имеют фенотип Т-хелперов (CD4) и только 20% фенотип Т-киллеров (CD8). Следует отметить, что роли интраэпителиальных Т-лимфоцитов, несущих гамма-, дельта- Т-клеточный распознающий рецептор, как "сторожевых" клеток, расположенных на территории слизистых оболочек, сегодня уделяется большое внимание. Кроме интраэпителиальных гамма-, дельта-Т-лимфоцитов CD8+ в слизистых оболочках имеются также интраэпителиальные В-лимфоциты, но они располагаются, в основном, в пределах тех участков, где больше всего присутствуют М-клетки.
Лимфоциты, расположенные в собственной пластинке слизистых оболочек, по функциональным особенностям сходны с лимфоцитами периферической крови. 1. И те, и другие выполняют как стимулирующую, так и супрессивную функцию при синтезе иммуноглобулинов. 2. Лимфоциты и той, и другой локализации, могут реализовывать цитотоксическую активность. 3. На поверхности лимфоцитов, расположенных в lamina propria и в периферической крови, имеются одинаковые структуры и почти в тех же пропорциях. Так, соотношение CD4+ и CD8+ Т-лимфоцитов для клеток обоих типов составляет 2:1. Однако, нельзя сказать, что это одни и те же клетки, поскольку лимфоциты периферической крови имеют несколько фенотипических поверхностных признаков, отличающих их от лимфоцитов lamina propria. Например, функциональное отличие Т-лимфоцитов-хелперов lamina propria и Т-лимфоцитов-хелперов периферической крови состоит в том, что только первые могут оказывать помощь В-лимфоцитам слизистых оболочек в их продукции секреторного IgA; Т-лимфоциты-хелперы периферической крови такой способностью не обладают.
Слизистая оболочка кишок в норме содержит активированные макрофаги, которые отличаются от моноцитов сыворотки крови, прежде всего тем, что находятся в состоянии высокой степени активации фагоцитоза и киллинговой способности. До сих пор не установлено, отчего это происходит: от большого количества инфекционных агентов в кишках либо от лимфокинов, вырабатываемых лимфоидной популяцией в пределах lamina propria. Действительно, присутствие микроорганизмов и их продуктов может усиливать высвобождение лимфокинов лимфоидными клетками слизистой оболочки. Важнейшими функциями макрофагов lamina propria является презентация антигенов и продукция цитокинов в этом участке.
Клетки, принимающие участие в становлении и функционировании иммунной системы, можно разделить на две группы: первую представляют основные клетки лимфоидного комплекса -Т-, В-лимфоциты и их субпопуляции, вторая группа - вспомогательные клетки иммунной системы: макрофаги, дендритные клетки, В-клетки, представляющие антиген в форме, доступной для его распознавания основными клетками системы (антигенпрезентирующие клетки), и стромальные клеточные элементы органов, где происходят процессы созревания (дифференцировки) основных клеток иммунной системы.Несколько в стороне стоят NK-клетки (нормальные киллерные клетки) - большие бластные, гранулярные лимфоциты. Функционально они не относятся к клеточным элементам специфического иммунитета, поскольку не имеют основного инструмента, который позволил бы им войти в категорию специфических клеточных факторов иммунитета, - антигенраспознающих рецепторов. Их участие в иммунном процессе - неспецифическое разрушение чужеродных клеток (некоторых опухолевых клеток, вирусинфицированных клеток, неродственных трансплантатов).
Основная помощь в делении лимфоцитов на отдельные типы (популяции) и субпопуляции пришла из анализа их поверхностных молекулярных структур (рецепторов, маркеров), определяемых с помощью моноклональных антител.
Поскольку в отдельно взятой молекуле образуется несколько таких антител, выявляющих отличающиеся антигенные детерминанты одной и той же молекулы, и, более того, в разных лабораториях идентичные антитела получили различные обозначения, решено было все обнаруженные антигенные специфичности одной молекулы объединить под общим названием CD-антигены с определенным порядковым номером. Свое обозначение они получили от английского словосочетания «cluster designation». К настоящему времени известно более 150 таких кластеров. Изучая динамику появления CD-антигенов, удалось не только четко разделить все лимфоциты на определенные популяции и субпопуляции, но и проследить процессы дифференцировки лимфоцитов, изменение поверхностных клеточных структур в результате выполнения той или иной функции и выявить предназначение самих CD-антигенов в процессах становления и развития клеточных участников иммунного ответа.
В-клетки
Как уже отмечалось, В-клетки - малые лимфоциты, проходят практически полностью весь путь своего развития в костном мозге.
После прошедших дифференцировок они покидают место основного развития и перемещаются в периферические лимфоидные органы, где заселяют так называемые В-зоны или Т-независимые зоны этих органов. Периферические В-лимфоциты, потенциально способные к выполнению своей защитной функции - синтезу антител, представляют собой сферические клетки диаметром 7 - 9 мкм, с узкой каймой цитоплазмы, гетерохроматиновым бобовидным или округлым ядром, заполняющим практически весь объем клетки. Цитоплазматическая мембрана характеризуется наличием небольших выростов - микроворсинок.
Созревание и функция В-клеток неразрывно связаны с экспрессией на их поверхности самых разнообразных поверхностных молекул, которые обеспечивают им взаимодействие как с другими клетками, так и с лигандами, что и лежит в основе «жизненного обеспечения» этого типа клеток. Особое внимание следует обратить на те поверхностные структуры, которые экспрессируются только на В-клетках. Это в первую очередь поверхностный, или мембранный, иммуноглобулин (slg, или mlg).
При наличии меченых антител к иммуноглобулину легко вычленить В-клетки из общей популяции лимфоцитов. На мембране клетки slg связан с другими молекулярными структурами, образуя В-клеточный антигенраспознающий рецепторный комплекс BCR (от англ. - В cell receptor). Среди них необходимо отметить CD79-a и -Ь, а также CD 19, CD20, CD21, CD81, Leul3. Другая группа антигенов CD характеризуется более широкой клеточной экспрессией. Эти молекулярные структуры встречаются не только на В-клетках и участвуют в таких общих с другими клетками лимфомиелоидного комплекса процессах, как обеспечение дифференцировки, миграции и рециркуляции, костимуляции, клеточного взаимодействия и др.
Т-клетки
Т-клетки практически неотличимы по своей морфологии от В-лимфоцитов. Единственное, подчас трудно уловимое различие касается микроворсинок плазматической мембраны, которые у данного типа клеток выражены несколько слабее по сравнению с В-клетками и напоминают скорее небольшие вздутия цитоплазмы, чем собственно ворсинки.
Как и в случае с В-клетками, единственный достоверный способ отличить Т-клетки от остальных лимфоцитов состоит в регистрации на их поверхности маркеров и в первую очередь тех, которые специфичны только для данного типа лимфоцитов. Среди них главным является Т-клеточный антигенраспознающий рецептор - TCR (от англ. - Т cell receptor), который совместно с дополнительными молекулярными структурами-корецепторами (CD3, CD4, CD8, CD45) образуют Т-клеточный антигенраспознающий комплекс.
Самые первые этапы дифференцировки Т-клеток совершаются в костном мозге. Здесь от общего лимфоидного предшественника происходит дивергенция развития по двум самостоятельным путям: В- и Т-клеточным направлениям. Однако если В-клетки для своего формирования почти полностью довольствуются микроокружением костномозговой ткани, то основным местом развития Т-клеток является тимус. На этом этапе дифференцировки в костном мозге ранние предшественники Т-клеток несут общие антигены с тканью головного мозга: Sca-1 и Sca-2, а также в малом количестве наиболее характерный антиген Т-клеток - CD90 (Thy-1).
Основным антигеном, позволяющим обнаружить ранние предшественники Т-клеток, является Sca-1. Экспрессия антигена Thy-1 слишком слаба, чтобы быть надежным маркером при изучении процессов развития. В тимусе как основном органе формирования фенотипически (но не функционально) зрелых Т-клеток осуществляются главные события, связанные с экспрессией на поверхности тимоцитов основного маркера - рецептора TCR и сопутствующих ему белков, маркеров-корецепторов CD4 и CD8 (молекул, определяющих деление Т-клеток на субпопуляции Т-хелперов и Т-киллеров соответственно). Здесь же происходит усиление экспрессии маркера всех Т-клеток - антигена Thy-1. В тимусе в результате положительной и отрицательной селекции Т-клетки приобретают два существенных свойства: клональность - экспрессию отдельно взятой клеткой и ее потомством TCR только одной определенной специфичности и неспособность реагировать на собственные антигены за счет элиминации клеток, несущих TCR к таким антигенам.
NK-клетки
Среди лимфоцитов периферии имеется популяция, получившая название натуральных киллерных клеток (NK). Характерной особенностью этих лимфоцитоподобных клеток является отсутствие у них структур, способных к специфическому распознаванию антигена, подобных тем, которыми обладают Т- и В-клетки. В то же время они, как и Т-киллеры, разрушают определенную категорию чужеродных клеток, но в отличие от последних неспецифическим образом. Способность к такому лизису объединяет их с активированными макрофагами. В организме NK-клетки составляют около 15 % от всех лимфоцитов.
Наиболее характерными, функционально значимыми молекулами клеточной поверхности NK, обеспечивающими их контакт с чужеродными клетками и последующий лизис этих клеток-мишеней, являются CD56 (NKH1) - изоформа адгезивного белка N-CAM, CD 161 (NKR.P-1), и KAR (от англ. - killer activation receptor). Кроме этих рецепторов как специфических молекулярных структур NK имеются и такие, которые являются общими с другими клетками. Не обладая эффектом киллинга, они способствуют взаимодействию NK с клеткой-мишенью. К ним относится CD 16 (FcyRIII) - низко аффинный рецептор К-клеток (субпопуляции NK), связывающий агрегированный IgGl и IgG3. В реализации цитолиза в качестве вспомогательных структур участвуют также молекулы адгезии: CD11/CD18 (LFA-1, Мас-1, CR4), CD44, CD2 (LFA-2) и др.
Уникальным свойством NK является их способность быть инертными к собственным (аутологичным) клеточным антигенам гистосовместимости при сохранении агрессивности по отношению к клеткам, несущим гомологичные аллоантигены. В иммунологии это явление получило название «метка своего». Значение подобной дискриминационной функции состоит в контроле за возможными мутационными изменениями собственных антигенов. В таком контроле за неизменностью собственных антигенов, по крайней мере тех, которые относятся к молекулам I класса МНС, принимают участие структуры, относящиеся к суперсемейству иммуноглобулинов (см. гл. 5). Среди них: NKB. 1 (распознавание молекулы I класса HLA-B у человека), группа белков KIR (от англ. - killer inhibitory receptor), которые распознают молекулы HLA-C. Белки группы KIR представлены несколькими изоформами, т. е. гены, контролирующие их, образуют целые полигенные семейства. В каждой конкретной клетке экспрессируется только одна из возможных изоформ, что позволяет говорить об определенной клональной организации NK.
Гистогенез NK связан с развитием лимфоцитов вообще и Т-клток в частности. Предполагается, что NK являются ответвлением от самых ранних этапов Т-клеточного пути дифференцировки вкостном мозге. О близости между NK- и Т-клетками говорит ряд фактов: наличие общих маркеров и ростстимулирующих факторов, присутствие предшественников NK в тимусе, функциональная идентичность по конечному результату - разрушение чужеродных клеток, наличие (3-цепи Т-клеточного антигенраспознающего рецептора (TCR) у NK. Незрелые, еще не начавшие экспрессию основных дифференцировочных маркеров-корецепторов CD4- и СБ8-тимоциты (CD4-CD8-) эмбрионального тимуса, попадая в микроокружение селезенки, развиваются в NK-клетки. Из 24 маркеров CD у NK-клеток 5 являются общими только с Т-клетками. В категорию общих маркеров входят, с одной стороны, такой мажорный антиген NK, как CD56, а с другой - специфический антиген Т-киллеров CD8, представленный у NK в формеции этих эволюциоино наиболее древних клеток крайне разнообразны: участие в неспецифическом иммунном ответе, удаление отживших и разрушенных клеток собственного организма (функция мусорщика), специфический иммунный ответ в качестве презентирующей антиген клетки, выполнение функции цитотоксической клетки, продукция большого арсенала цитокинов и иных эндогенных соединений, регулирующих иммунный процесс.
Морфологически макрофаги детально охарактеризованы. Они представляют собой крупные полиморфные клетки диаметром 15 - 25 мкм, с ядром неправильной формы, имеющим тонко структурированный хроматин. Зрелые макрофаги подразделяются на подвижные, мигрирующие в очаги воспаления, места тканевой деструкции, и резидентные, локализованные в отдельных органах и тканях. К резидентным макрофагам относятся гистиоциты соединительной ткани, звездчатые ретикулоэндотелиоциты печени (купферовские клетки), альвеолярные макрофаги легких, макрофаги костного мозга, макрофаги селезенки и лимфатических узлов, клетки микроглии нервной системы.
Гистогенез макрофагов, как и других клеток лимфомиелоидного комплекса, начинается от стволовой кроветворной клетки костного мозга. Весь путь развития макрофагов проходит под влиянием клеточных и гуморальных факторов микроокружения. Первый этап дифференцировки приводит к образованию клетки-предшественницы для всех ростков миелоидного пути развития. На этом этапе действуют в первую очередь интерлей-кин-3 (ИЛ-3) и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ). Эти же факторы оказывают влияние и на последующие этапы дифференцировки, приводящие к образованию общего предшественника макрофагов и гранулоцитов, монобластов, промоноцитов. При образовании моноцитов определенная роль принадлежит ИЛ-6. Костномозговой путь развития завершается образованием промоноцита, который, мигрируя в кровь, трансформируется в моноцит. В крови моноцит в качестве самостоятельной клетки существует около 2 -6 ч, после чего мигрирует в периферические органы, где через стадию незрелого макрофага завершает свой путь развития, превращаясь в зрелую, не способную к пролиферации форму.
Среди мембранных белков макрофаги в отличие от других клеток имеют рецепторы ко всем классам иммуноглобулинов (CD 16, CD23, CD32, CD64). Важными для макрофагов как антигенпрезентирующих клеток являются корецепторы CD80 и CD86, хотя их полноценная экспрессия начинается только после стимуляции клеток. Два рецептора - CD1 lb/CD18 и CDllc/CD18 - существенны не только для связи с компонентами комплемента, но и для распознавания опсонизированных микробных и иных клеток, что приводит к эффективному их поглощению макрофагами. Для полноценной реализации своей основной функции - поглощения микробных тел, важен также рецептор CD 14, взаимодействующий с липополисахаридами бактерий. При взаимодействии с межклеточным матриксом и другими клетками макрофаги используют рецепторы, относящиеся к группе интегринов, например CD1 la/CD18, CD1 lb/ CD18, CD49 и др. Являясь активными эффекторными и регуляторными клетками в проявлении как неспецифического, так и специфического иммунного ответа, макрофаги обладают также набором рецепторов к цитокинам и другим биологически активным соединениям.
Дендритные клетки
Значительная роль на начальных этапах формирования специфического иммунного ответа принадлежит дендритным клеткам (ДК), способным представлять антиген в иммуногенной форме и сохранять его для ускоренного развития вторичного иммунного ответа, т.е. поддерживать иммунологическую память. Различают несколько типов дендритных клеток. Основными являются дендритные клетки тимуса, лимфатических узлов, слизистых оболочек, а также зародышевых центров - мест концентрации В-лимфоцитов в лимфоидной ткани. Предполагается, что клетки Лангерганса (белые отростчатые эпидермоциты) и вуалевые клетки лимфы представляют собой предшествующие, этапные формы дендритных клеток тимуса и лимфатических узлов. В то же время дендритные клетки зародышевых центров рассматриваются как самостоятельная субпопуляция локального происхождения.
Основной морфологической характеристикой всех дендритных клеток является наличие длинных выростов цитоплазмы (отсюда и название клеток - древовидный, ветвящийся). В строме лимфоидных органов эти клетки прочно фиксированы и окружены контактирующими с ними лимфоцитами. Гистогенез дендритных клеток точно не охарактеризован. Ясно только то, что они, за возможным исключением фолликулярных дендритных клеток, имеют костномозговое происхождение. При этом требуется дальнейшее внимательное изучение их полного пути развития. Клетки, ткани и органы иммунной системы входят в состав лимфомиелоидного комплекса. Комплекс включает костный мозг, тимус, селезенку, лимфатические узлы, лимфоидную ткань, ассоциированную с кишечником, соединительную ткань. Одна из определяющих функций комплекса состоит в обеспечении кроветворения (миелопоэза) и образовании клеток иммунной системы (лимфопоэза). Клетки крови (эритроциты, мегакариоциты, гра нулоциты, моноциты) и лимфоциты имеют общего родоначального предшественника - стволовую кроветворную клетку, локализованную в костном мозге. Однако на самом раннем этапе костномозговой дифференцировки происходит дивергенция общего стволового элемента на стволовую клетку для миелопоэза и стволовую клетку для лимфопоэза. Именно с данного момента лимфоидная (иммунная) система вступает в самостоятельный ранг, при этом ее автономия не означает полного разрыва с другими функциональными системами организма. Объединяющим моментом является в первую очередь набор общих регуляторных молекул (цитокинов, гормонов, медиаторов нервной системы и т.д.).
Широкое распространение по организму клеток лимфоидной системы роднит ее с кровеносной системой. «Оккупация» организма лимфоцитами проявляется в формах организации лимфоидной ткани: наличии диффузной инфильтрации лимфоцитами различных тканевых образований, скопления лимфоцитов в слизистых покровах, разветвленной сети лимфатических узлов и соединяющих их сосудов. Основные клетки иммунной системы - это Т- и В-лимфоциты, NK-клетки, макрофаги, дендритные клетки. Каждый из этих клеточных типов имеет свое, свойственное лишь ему сочетаниеповерхностных рецепторов и маркеров, что позволяет дифференцировать их не только морфологически, но и по особенностям экспрессии поверхностных молекул.
Основным местом образования лимфоцитов служит кроветворная ткань селезенки и лимфатических узлов. В костном мозге и периферической крови в норме встречаются только зрелые лимфоциты. При патологии в костном мозге и периферической крови могут появляться незрелые и атипические формы клеток лимфоидного ростка.
Клетки лимфоидного ростка
К клеткам лимфоидного ростка относятся:
Лимфобласт
Лимфобласт - клетка лимфоидного ряда размером 12 - 18 мкм. Ядро круглое или слегка овальное, распределение хроматина в нем неравномерное, рыхлое. В ядре чаще содержится 1, реже 2 - 3 ядрышка голубого цвета. Цитоплазма базофильная, с отчетливо выраженной перинуклеарной зоной.
Лимфобласты (фотографии)
Пролимфоцит
Пролимфоцит - клетка несколько меньшего размера, чем лимфобласт (12 - 15 мкм). Структура ядра грубая, отчетливо видны 1 - 2 нуклеолы светло-фиолетового цвета. Цитоплазма не отличается от таковой лимфобласта.
В норме лимфобласты и пролимфоциты встречаются в селезенке и лимфоузлах, в костном мозге и периферической крови они появляются только при патологии.
Пролимфоциты (фотографии)
Лимфоцит
Лимфоцит - зрелая клетка лимфоидного ряда, размером чаще 7 - 10 мкм. Ядро круглое, овальное, иногда бобовидное. Структура ядра грубая, чаще состоит из грубых комков базихроматина и оксихроматина, создавая впечатление глыбчатости. Ядро окрашивается в темно- или светло-фиолетовый цвет, в нем иногда обнаруживаются небольшие светлые участки, имитирующие ядрышки. Цитоплазма лимфоцита светло-синяя с просветлением вокруг ядра. Часть лимфоцитов имеет в цитоплазме азурофильную зернистость, окрашивающуюся в красный цвет. Ободок цитоплазмы может иметь различные размеры, в связи с чем, лимфоциты делят на три группы: узкоцитоплазменные, среднецитоплазменные и широкоцитоплазменные. В литературе широкоцитоплазменные лимфоциты часто называют "большими", диаметр их составляет 9 - 15 мкм, цитоплазма занимает значительную часть клетки, светло-голубая, часто с крупными азурофильными гранулами. Хроматин ядра грубый, но не такой плотный как у остальных лимфоцитов. Среднецитоплазменные и узкоцитоплазменные лимфоциты часто называют "малыми", они составляют большую часть лимфоцитов периферической крови. Их диаметр 6 - 9 мкм, ядро круглое или слегка овальное, темноокрашенное, с плотным хроматином, занимает большую часть клетки. Цитоплазма видна как узкий ободок или "серп" вокруг ядра.
Малые лимфоциты (фотографии)
Большие лимфоциты (фотографии)
Атипичные лимфоциты
При различных патологических процессах могут обнаруживаться атипичные формы лимфоцитов :
- клетки небольших размеров с пикнотическим ядром и еле заметной цитоплазмой;
- клетки Ридера , имеющие почкообразную зазубренную форму ядер или двудольчатые формы ядер;
- клетки с вакуолизацией в цитоплазме , реже - в ядре;
- голые лимфоцитарные ядра ;
- клетки лейколиза - разрушенные в процессе приготовления препарата лимфоциты. В большом количестве встречаются при хроническом лимфолейкозе (клетки Боткина-Гумпрехта);
- атипичные мононуклеары - большие клетки с обильной базофильной цитоплазмой. Часто темная базофильная периферическая цитоплазма отделяется тонкой линейной границей от более бледной околоядерной зоны. Ядра большие, могут содержать ядрышки и иногда имеют вдавления. Они очень похожи на ядра моноцитов. Такие клетки встречаются преимущественно при инфекционном мононуклеозе, но могут встречаться и при других вирусных инфекциях;
- плазматизированные лимфоциты - широкоплазменные лимфоциты с интенсивно синей цитоплазмой и тяжистым ядром. Встречаются при вирусных инфекциях.
Клетки лейколиза (фотографии)
Атипичные мононуклеары (фотографии):
Плазматизированные лимфоциты (фотографии):
Плазмобласт, проплазмоцит и плазмоцит
К клеткам лимфоидного ростка относятся также плазмобласт, проплазмоцит и плазмоцит.
Плазмобласт - клетка размером 16 - 20 мкм. Ядро нежной структуры, занимает большую часть клетки, располагаясь центрально или несколько эксцентрично. Нуклеолы (1 - 2) не всегда четко видимы. Цитоплазма интенсивно синего цвета; характерна перинуклеарная зона просветления.
Проплазмоцит - переходная форма от плазмобласта к зрелому плазмоциту. Размер клетки несколько больше, чем у зрелого плазмоцита (иногда до 20 мкм). Ядро занимает большую часть клетки и часто расположено эксцентрично, в нем могут быть видны остатки нуклеол. Цитоплазма резко базофильна с просветлением вокруг ядра, иногда синий цвет выражен меньше.
Плазмоциты - зрелые плазматические клетки. Весьма разнообразны по форме и величине (размер от 8 до 20 мкм). Ядро круглой или овальной формы, имеет грубую колесовидную исчерченность и расположено эксцентрично. Цитоплазма окрашена в интенсивно синий цвет с ясно выраженной перинуклеарной зоной просветления; может содержать различные вакуоли, что придает ей ячеистое строение. Плазматические клетки больших размеров могут иметь цитоплазму, окрашенную в серо-голубой цвет с менее отчетливой перинуклеарной зоной или с отсутствием ее. Иногда встречаются двух- и трехъядерные формы.
Плазматические клетки (микрофотографии):
В норме единичные плазмобласты, проплазмоциты и плазматические клетки встречаются в пунктате лимфоузлов и селезенки, в костном мозге встречаются единичные плазмоциты. В периферической крови плазматические клетки встречаются только при патологии: при ряде инфекций (корь, краснуха, ветряная оспа), сывороточной болезни, некоторых болезнях кожи, инфекционном мононуклеозе, агранулоцитозе, туберкулезе, лимфогранулематозе, тяжелом сепсисе, крупозной пневмонии, актиномикозе, циррозе печени, миеломной болезни.
Плазматические клетки при миеломной болезни обычно называют миеломными, так как они могут иметь характерные черты. Миеломные клетки имеют часто большие размеры, достигающие иногда 40 мкм и более в диаметре. Ядро нежное, содержит 1 - 2 больших или несколько мелких ядрышек, окрашенных в голубой цвет. Нередко встречаются клетки с 3 - 5 ядрами. Цитоплазма больших размеров, окрашивается в различные цвета: светло-голубой, светло-фиолетовый, интенсивно-фиолетовый, а иногда красноватый, обусловленный присутствием гликопротеидов. Околоядерное просветление выражено нечетко или отсутствует. Иногда в цитоплазме находят гиалиновые включения - тельца Русселя величиной 2 - 4 мкм, количество которых варьирует.
Литература:
- Л. В. Козловская, А. Ю. Николаев. Учебное пособие по клиническим лабораторным методам исследования. Москва, Медицина, 1985 г.
- Руководство по клинической лабораторной диагностике. (Части 1 - 2) Под ред. проф. М. А. Базарновой, академика АМН СССР А. И. Воробьева. Киев, "Вища школа", 1991 г.
- Руководство к практическим занятиям по клинической лабораторной диагностике. Под ред. проф. М. А. Базарновой, проф. В. Т. Морозовой. Киев, "Вища школа", 1988 г.
- Справочник по клиническим лабораторным методам исследования. Под ред. Е. А. Кост. Москва "Медицина" 1975 г.
- Исследование системы крови в клинической практике. Под ред. Г. И. Козинца и В. А. Макарова. - Москва: Триада-Х, 1997 г.
Врождённые лимфоидные клетки (ВЛК) это группа лимфоцитов которые вовлечены в быстрое цитокин-зависимое реагирование организма во время воспалительного процесса.
Они играют важную роль в гомеостазе органов тканей и в иммунном ответе организма на внешние раздражители а также регулируют процессы развития клеток приобретённого иммунитета.
В отличии от "обычных" лимфоцитов приобретённого иммунитета у ВЛК отсутствуют антиген-специфичные рецепторы, они могут реагировать на широкий спектрум воспалительных стимулов.
Как и Т-хелперы, ВЛК имеют общего предшественника охарактеризованного как клетка экспрессирующая транскрипторный фактор inhibitor of DNA binding 2 (ID2) .
На сегодняшний день выделяют три группы ВЛК в зависимости от их функции и экспрессии воспалительных медиаторов (Рисунок 1).
1-ая группа ВЛК делят множество характеристик с естественным киллерам (ЕК) (Natural killer, NK cells). Также как и ЕК, 1-тип ВЛК экспрессируют интерферон-γ и нуждаются в транскрипторном факторе Т-bet для своего развития, но в отличие от ЕК, они нe экспрессируют перфорин, гранзим В (granzyme B) и рецептор киллерных клеток (Killer-cell Ig-like receptor) и также активизируются в основном на интерлейкин-7 (ИЛ-7) чем ИЛ-15. Высокое содержание 1-го типа ВЛК были обнаружены в кишечнике пациентов страдающие болезнью Крона.
2-ая группа ВЛК имеют способность продуцировать ИЛ -13 , -5 и -9 . Впервые эта популяция клеток была описана в контексте анти-гельминтной реакции организма . Исследователи показали что 2-ой тип ВЛК стимулирует эозинофилию и гиперплазию бокаловидных клеток , два важных процесса в анти-глистном ответе организма. Также недавно, 2-ой тип ВЛК был обнаружен в лёгких и играет важную роль в патофизиологии астмы . Для дифференциации во 2-ой тип ВЛК необходима активация таких транскрипторных факторов как retinoic acid receptor–related orphan receptor (ROR ) α и Gata3 .
3-я группа ВЛК для своего развития также нуждаться в Gata3 и ROR-γt . Эта группа делится на 3 под-группы. 1) Клетки индуцирующие лимфоидную ткань (Lymphoid tissue inducer, LTi ) , они необходимы для лимфоидного органогенеза и продуцируют ИЛ -17 и -22 . 2) ИЛ-22 продуцирующие ВЛК (natural cytotoxicity receptor, NCR позитивные ) учавствуют в защите организма от внешних патогенов . 3) ИЛ-17 продуцирующие ВЛК (NCR негативные ) были обнаружены у пациентов страдающие язвенным колитом, также существуют исследования показывающие вовлечение этой группы клеток в прогрессии астмы и других аллергически-воспалительных процессах.
| Рисунок 1 |
Что мы знаем....
ВЛК это новая популяция лимфоцитов, охарактеризованная относительно недавно.
ВЛК может продуцировать широкий спектрум цитокинов.
ВЛК реагирует в НЕ антиген зависимой манере.
ВЛК функционируют независимо от клеток приобретённого иммунитета но в тоже время влияют на приобретённый иммунитет.
Что не знаем.....
Как ВЛК взаимодействуют с клетками приобретённого иммунитета т.к. Т-хелперы.
Изначально ВЛК это очень малочисленная популяция клеток но в критических ситуациях (воспаление, защита от инфекционных патогенов),эта популяция клеток резко увеличивается. И остаётся неизвестным механизмы запускающие экспансию ВЛК.
Существуют ли дополнительные саб-группы ВЛК?
Литература:
Nature Reviews Immunology
(2013)
13
, 75-87
Immunology and Cell Biology (2013) 91, 215–224
Curr Opin Immunol (2014) 27, 75–82
2180 0
Нарушение регуляции иммунной системы может приводить к внезапному появлению новообразований, особенно лимфоидных клеток. Это происходит у пациентов с первичными иммунодефицитными заболеваниями, СПИДом и иммуносупрессией после трансплантации органов. При этих состояниях особенно часто развиваются агрессивные В-клеточные лимфомы, часто ассоциированные с вирусом Эпштейна-Барр. В этом подразделе сначала изложены общие черты лимфоидных опухолей, а затем рассказано о специфических свойствах их наиболее важных типов.
Лимфоидный лейкоз и лимфома были изначально отнесены к разным нозологиям на основании клеточной морфологии и клинических данных. Определение «лейкоз» подразумевает, что опухолевые клетки встречаются преимущественно в периферической крови и/или в костном мозге. Лимфома представляет собой твердые массы в лимфатических узлах, селезенке , тимусе или нелимфоидных органах. Иногда одни и те же типы опухолевых клеток могут встречаться во всех указанных местах (лейкоз/лимфома).
В 1996 г. Всемирная организация здравоохранения (ВОЗ) рекомендовала использовать классификацию опухолей, основанную на морфологии исходной клетки: В-клетки в противопоставление T/NK (Т-клетки/натуральные киллеры), и степени дифференцировки: незрелые (клетки-предшественники) в противоположность зрелым (периферическим) (табл. 17.4). Считается, что опухоли вырастают из трансформированных лимфоидных клеток, которые останавливаются в своем развитии. Они имеют такие же поверхностные маркеры и многие другие свойства, как и соответствующие нормальные клетки на этой стадии развития.
Опухолевые клетки, однако, могут не продолжать созревание и накапливаться в большом количестве; все они происходят от единого клона (т.е. они моноклональны). Они также будут занимать одни и те же участки и мигрировать теми же путям развития, что и их нормальные двойники, а именно костный мозг для незрелых В-клеток, тимус для незрелых Т-лимфоцитов и т.д.
Анализ ДНК, извлеченной из В- и Т-клеточных опухолей (Саузерн блот), выявляет одинаковый участок связывания и в гене иммуноглобулинов, и гене Т-клеточного рецептора соответственно. Такие данные свидетельствуют, что все опухолевые клетки имеют одинаковую реаранжировку этих генов, что и позволяет судить о моноклональности такого лимфоидного роста. Для определения малой популяции моноклональных клеток перед проведением анализа по методу Саузерн блот может быть использована ПЦР.
Для некоторых лимфоидных новообразований были определены уникальные молекулярные аномалии, которые могут способствовать трансформации этих клеток. Эти молекулярные изменения также внесены в схему классификации. Поскольку классификация ВОЗ основывается в большей степени на природе клеток, чем на клинических проявлениях, лейкозы и лимфомы не различают, если они представлены одинаковыми типами опухолевых клеток. Классификация ВОЗ имеет большое практическое значение, поскольку терапия лейкозов и лимфом часто одна и та же.
В-клеточные новообразования
Лимфобластный лейкоз/лимфома из В-клеток-предшественников
В-клеточный острый лимфобластный лейкоз/лимфома (В-ОЛЛ) затрагивает про- и пре-В-клетки или все незрелые стадии развития В-клеток, что демонстрируется экспрессией поверхностных CD-маркеров и стадией реаранжировки гена lg в каждом индивидуальном случае лейкоза (рис. 17.9). Опухолевые клетки могут экспрессировать маркеры бластов или маркер стволовых клеток CD34 (особенно про-В-клетки), а также «ранние» маркеры В-лимфоцитов: CD10 и CD19. Так же как и нормальные про-В- или пре-пре-В- и пре-В-клетки, соответствующие клетки ОЛЛ экспрессируют терминальную дезоксинуклеотидилтрансферазу (TdT) в ядрах.Рис. 17.9. Соотношение стадий развития В-клеток с В-клеточными злокачественными опухолями
Экспрессия этого фермента, в норме необходимого для реаранжировки генов lg, отражает тот факт, что эти клетки В-ОЛЛ находятся в процессе генной реаранжировки. Это значит, что они еще не экспрессируют полную молекулу lg на своей поверхности и имеют только цитоплазматические μ-цепи, что соответствует стадии пре-В-клеток. При лечении детей с этим типом лейкоза наиболее эффективна химиотерапия.
Существует также вариант агрессивного незрелого В-ОЛЛ, который является лейкозным двойником лимфомы Беркитта, при котором имеются сходные характеристики транслокации генов. Эти клетки похожи на незрелые В-клетки, только что вышедшие на периферию из костного мозга. Они экспрессируют CD20, обладают «выключенной» TdT, их ген lg полностью реаранжирован, а на клеточной поверхности находятся IgM.
Лимфома/лейкоз Беркитта
Лимфома Беркитта может проявляться и как лейкоз, и как лимфома. Она характеризуется транслокацией онкогена с-тус в локус гена Н-цепи lg или одного из двух генов L-цепей - t(8; 14), t(8; 22) или t(2; 8) (рис. 17.10). Белок с-тус в норме вовлекается в активацию генов для клеточной пролиферации, когда покоящаяся клетка получает сигнал к делению. Транслокация в гены lg приводит к увеличению экспрессии с-тус и активации клеточной пролиферации. Возможно, антигенная стимуляция В-клеток инициирует повышение экспрессии с-тус под контролем гена lg.
Рис. 17.10. Некоторые В-клеточные новообразования, связанные с транслокацией генов в хромосомный локус, кодирующий ген Н-цепи Ig на хромосоме 14
В экваториальной Африке эта лимфома является эндемичной и связана с инфицированием В-клеток вирусом Эпштейна-Барр Лимфома Беркитта - это одна из опухолей, часто развивающихся у пациентов с иммуносупрессией (при СПИДе и медикаментозной иммуносупрессии). В клетках лимфомы Беркитта иногда обнаруживается геном вируса Эпштейна - Барр.
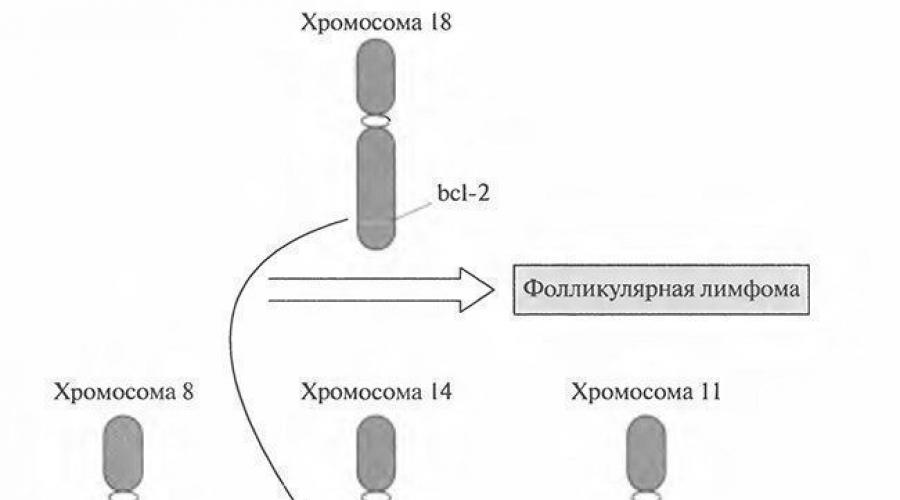
Фолликулярная лимфома
Фолликулярная лимфома представляет собой трансформированные В-клетки, в норме обнаруживаемые в фолликулах лимфатических узлов (рис. 17.11). В-клетки стимулируются антигеном в фолликуле, образуя зародышевый центр. Они могут отвечать на эту стимуляцию пролиферацией, переключением изотипов иммуноглобулинов и дифференцировкой в плазматические клетки. Если их антитела плохо соответствуют этому антигену или имеют к нему низкую аффинность, то клетки подвергаются апоптозу, или программируемой клеточной гибели. При фолликулярных лимфомах ген bcl-2, который продуцирует белок, препятствующий апоптозу, транслоцируется в ген Н-цепи Ig t(14;18) (см. рис. 17.10).
Рис. 17.11. Срез нормального лимфатического узла с указанием участков, вовлекаемых в Т- и В-клеточные лимфомы; ХЛЛ/ЛМЛ, лимфома из клеток мантийной зоны и фоликуллярная лимфома происходят из В-клеток
Это приводит к продолжительной экспрессии белка bcl-2, предотвращающего гибель клеток. Фактически, такие В-клеточные новообразования имеют только низкий уровень пролиферации, заболевание отличается длительным хроническим течением. Их фенотип (поверхностные CD-маркеры) соответствует фенотипу у нормальных В-клеток фолликулярного центра: CD19+, CD20+, CD10+ и поверхностные иммуноглобулины.
Лимфома из клеток мантийной зоны
В норме зародышевый центр окружен венцом малых покоящихся В-клеток, которые не ответили на антиген (см. рис. 17.11). Новообразования этих клеток мантийной зоны обладают таким же В-клеточным фенотипом, как и их нормальные двойники, CD19+, CD20+. CD5+, slgM. При многих лимфомах из мантийных клеток происходит транслокация гена bcl-1 в область гена Н-цепи Ig - t(ll; 14), приводящая к избыточной экспрессии белка циклина D1 (см. рис. 17.10). Циклин D1 в норме отвечает за стимуляцию прогрессии клеточного цикла от фазы G1 к фазе S, приводящей к делению клетки. Эта лимфома обладает более высокой пролиферативной активностью и более агрессивным течением, чем фолликулярная.Лимфома из клеток краевой зоны
Лимфомы из клеток краевой зоны наиболее часто встречаются в лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT) , и, что интересно, могут быть связаны с хронической антигенной стимуляцией или аутоиммунным заболеванием этого органа. Например, хроническая инфекция Helicobacter pilory желудка может привести к развитию лимфомы желудка, которую, таким образом, можно предотвратить терапией антибиотиками. Сходным образом у пациентов с аутоиммунным тиреоидитом (тupeoидит Хашимото) и аутоиммунным заболеванием слюнных желез (синдром Шегрена) существует высокий риск развития В-клеточной лимфомы в пораженном органе.Взаимосвязь между этими аутоиммунными заболеваниями или инфекцией и лимфомой позволяет предложить две интересные и не противоречащие друг другу гипотезы. Во-первых, хроническая антигенная стимуляция обеспечивает благоприятную почву для развития В-клеточной лимфомы. В-клетки, в которых гены иммуноглобулинов продолжают подвергаться соматическим мутациям, могут накапливать трансформирующие мутации при продолжительной стимуляции. Во-вторых, дефект в регуляции В-лимфоцитов ввиду то ли внутренних причин, то ли недостаточного подавления их активности Т-лимфоцитами приводит как к аутоиммунному заболеванию, так и, возможно, к лимфоме.
Опухолевые клетки иммунной системы мигрируют по тем же путям, что и их нормальные двойники. Лимфома краевой зоны долгое время остается локализованной, а затем повторяет движение нормальных клеток MALT, перемещаясь в другие участки MALT.
Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов
Считается, что хронический лимфоцитарный лейкоз (ХЛЛ) / лимфома из малых лимфоцитов (ЛМЛ) является опухолевым перерождением субпопуляции В-лимфоцитов, известных как В-1-клетки. У некоторых пациентов ее первым клиническим проявлением является лейкоз (с первичным вовлечением крови и костного мозга), тогда как у других больных сначала вовлекаются лимфатические узлы (см. рис. 17.11). Так же как и нормальные В-1-клетки, клетки ХЛЛ/ЛМЛ экспрессируют маркеры зрелых В-клеток CD19 и CD20, а также CD5 и поверхностный IgM.Хронический В-клеточный лейкоз - это наиболее распространенный лейкоз в Северной Америке и Западной Европе. Особенно часто он встречается у людей старших возрастных групп. Такие больные крайне чувствительны к инфекции, что наводит на мысль о том, что их неопухолевые клетки функционируют недостаточно хорошо. Характерно наличие аутоантител, особенно против эритроцитов, приводящих к развитию гемолитической анемии.
Антитела могут синтезироваться опухолевым клоном или, что бывает чаще, неизмененными В-клетками. Взаимосвязь этих аутоиммунных состояний с лейкозом/лимфомой снова наводит на мысль о том, что лимфоидное новообразование возникает на месте нарушения иммунной регуляции или по причине ее возникновения. Заболевание характеризуется долгим клиническим течением, но возможно и массивное поражение каждого органа, периферической крови и костного мозга опухолевыми клетками.
Диффузная крупноклеточная лимфома из В-клеток
Диффузная крупноклеточная лимфома из В-клеток - это гетерогенная группа лимфом, которые могут возникать de novo на единственном участке и быть формой прогрессии одной из перечисленных медленно растущих лимфом (например, фолликулярной) или следствием плохо контролируемой инфекции вирусом Эпштейна-Барр в организме больных, получающих иммуносупрессивные препараты (например, у ВИЧ-позитивных лиц, больных после трансплантации органов или у пациентов с иммунодефицитом). Во всех случаях клетки экспрессируют В-клеточные маркеры CD19 и CD20 и часто - поверхностный Ig. Одна подгруппа имеет транслокацию bcl-6 - протоонкогена, который в норме действует как супрессор транскрипции некоторых генов, необходимых для нормального развития В-лимфоцитов и зародышевых центров.Поведение возникших de novo диффузных крупноклеточных В-клеточных лимфом непредсказуемо. Благодаря современному микроанализу кДНК для этих разновидностей опухолей лимфомы разделили на две крупные группы. Это разделение связано с различиями в образцах генной экспрессии (продукция иРНК), причем выявлена корреляция между этими молекулярными образцами и поведением опухоли. Такая молекулярная характеристика должна привести к лучшему пониманию биологии лимфом и разработке практических рекомендаций к лечению.
Взаимосвязь инфекции вирусом Эпштейна-Барр с диффузными крупноклеточными лимфомами из В-клеток и лимфомой Беркитта у пациентов с иммуносуппрессией наглядно показывает, каковы последствия нарушения саморегуляции иммунной системы. Инфекция В-клеток вирусом Эпштейна - Барр (через рецептор вируса CD21) приводит к поликлональной пролиферации В-лимфоцитов. У здоровых индивидуумов В-клетки, инфицированные вирусом Эпштейна-Барр, удаляются из организма цитотоксическими Т-лимфоцитами.
Если Т-клеточный контроль оказывается недостаточным, инфицированные В-лимфоциты продолжают экспансивный рост, и в некоторых из них могут произойти дополнительные мутации, такие как транслокация гена с-тус, что вызовет злокачественную трансформацию клеток и последующий независимый рост. Например, вирус Эпштейна-Барр можно использовать для продления жизни В-клеток в тканевой культуре, в которой В-клетки не являются объектом, контролируемым Т-лимфоцитами. Это также важно в клинической практике: у пациентов, получающих иммуносупрессивную терапию, существует точка, в которой пока еще возможно предотвратить развитие В-клеточной лимфомы, прекратив терапию и разрешив иммунной системе организма сдерживать патологическую В-клеточную пролиферацию. Конечно, это невозможно у больных СПИД.
Опухоли плазматических клеток
Опухолевый рост плазматических клеток может происходить на ограниченном участке (изолированно), приводя к плазмоцитоме или на многих, преимущественно в костях, и тогда он называется множественной или плазмоклеточной миеломой. Как и для нормальных плазматических клеток, фактором роста для миеломных клеток является IL-6.Опухолевые плазматические клетки могут продолжать синтезировать и секретировать свои продукты - белки, составляющие иммуноглобулины В большинстве случаев эти секретируемые моноклональные белки вызывают у пациента больше проблем, чем сами перерожденные клетки. Депозиты легких цепей, названные амилоидом, могут вызывать недостаточность разных органов, особенно почек. Выделение из мочи некоторых больных множественной миеломой свободных легких цепей иммуноглобулина - белка Бенс-Джонса - позволяет понять их структуру. Эти белки являются моноклональными; они определяются в сыворотке и иногда в моче в виде М-пика в у-области на электро-фореграмме.
Пик выше пограничной полосы формируется вследствие того, что все иммуноглобулины идентичны по размеру и заряду и мигрируют в одно и то же место. В большинстве случаев продуцируются моноклональные IgG; IgA являются следующим наиболее часто обнаруживаемым изотипом иммуноглобулина. Уровни других нормальных Ig у этих пациентов значительно снижаются, что делает их иммуносупрессивными по продукции антител и, таким образом, восприимчивыми к инфекции. До появления развернутой клинической картины миеломы у больных может появляться небольшое количество моноклональных Ig в течение многих лет. Многие пациенты остаются на этой стадии, и заболевание у них не прогрессирует. Маленькие М-пики могут быть обнаружены в ассоциации с другими лимфоидными новообразованиями, такими как ХЛЛ, и даже при неопухолевых состояниях.
Лимфоплазмоцитарная лимфома (макроглобулинемия Вальденстрема)
Лимфоплазмацитарная лимфома/макроглобулинемия Вальденстрема - это новообразование единственного клона В-клеток. При микроскопии оно выглядит как смесь лимфоцитов, плазматических клеток и чего-то промежуточного - лимфоплазмоцитоидных клеток. Опухолевые клетки находятся в лимфатических узлах, костном мозге и селезенке. Хотя эти лимфомы встречаются нечасто, они представляют интерес для иммунологов вследствие гиперпродукции IgM. Крупный размер и высокая концентрация IgM в крови может сочетаться с медленным кровотоком и «засорением» сосудов их агломератами (синдром повышенной вязкости крови). У некоторых пациентов IgM имеют патологическую структуру, вследствие чего при охлаждении они выпадают в осадок (с образованием криоглобулинов) и вызывают расстройства микроциркуляции в конечностях больных (пальцы рук и ног).Т-клеточные новообразования
Острый лимфобластный лейкоз/лимфома из Т-клеток-предшественников
Острый лимфобластный лейкоз из клеток-предшественников Т-лимфоцитов (Т-ОЛЛ) - это новообразование из незрелых Т-клеток с характеристиками незрелых тимоцитов, остановившихся в своем развитии. Как показано на рис. 17.12, клетки Т-ОЛЛ экспрессируют все Т-клеточные маркеры (CD2, CD5 и CD7), которые появляются на ранних стадиях развития Т-клеток. Некоторые Т-ОЛЛ обладают характеристиками незрелых клеток тимуса и не экспрессируют CD4 или CD8 (т.е. они дважды негативные).
Рис. 17.12. Соотношение стадий развития Т-клеток и злокачественных новообразований из них
Большинство нормальных тимоцитов и клеток Т-ОЛЛ являются более зрелыми, экспрессируя оба маркера: и CD4, и CD8 (дважды позитивные); при этом CD3 на своей поверхности они экспрессируют в небольшом количестве или совсем не экспрессируют (их обозначают как общие тимоциты). В этих клетках еще не завершена реаранжировка генов их Т-клеточного рецептора (TCR) и все еще экспрессируется TdT. Острый лимфобластный лейкоз проявляется в виде лейкоза или тяжелого процесса в тимусе. Лечение не столь успешно, как при В-ОЛЛ.
Новообразования из периферических Т-клеток
Клинические проявления лимфом из периферических Т-клеток разнообразны. Они обнаруживаются там, куда обычно мигрируют Т-клетки, а именно в коже, легких, стенках сосудов, ЖКТ и лимфатических узлах. Они также сохраняют некоторые функции нормальных зрелых Т-клеток. Вследствие этого продукция цитокинов злокачественными клетками приводит к скоплению воспалительных клеток, в том числе эозинофилов, плазмоцитов и макрофагов. Часто лимфы из периферических Т-клеток более агрессивны, чем из В-клеток. Две болезни из этой группы рассмотрим подробнее.Кожная Т-клеточная лимфома
Если опухоль ограничена пределами кожи, Т-клеточную кожную лимфому часто называют ее исторически сложившимся названием «грибовидный микоз», поскольку раньше считалось, что пациенты страдают от хронической грибковой инфекции, при которой отмечаются восковое перерождение и истончение кожи в течение многих лет. Сейчас понятно, что это кожное заболевание обусловлено инфильтрацией эпидермиса злокачественными СD4+-Т-клетками. В дальнейшем клетки могут распространяться в лимфатические узлы и даже в кровь. Злокачественные Т-клетки, обнаруживаемые в кровотоке, называются клетками Сезари; соответственно, у больного развивается синдром Сезари.Т-клеточная лимфома/лейкоз взрослых
Т-клеточная лимфома/лейкоз взрослых (ТЛЛВ) представляет собой агрессивное Т-клеточное новообразование. Его описали в 1970-е гг. в одной из областей Японии, где оно являлось эндемичным. Также его обнаружили у обитателей Карибских островов, в некоторых частях центральной Африки и в небольшой области на юго-востоке США. Обычно ТЛЛВ является новообразованием из зрелых СD4+-Т-клеток. Для таких клеток аутокринным фактором роста является IL-2. При ранних попытках терапии показано, что это новообразование временно (несколько месяцев) отвечает на введение антител (названных как анти-Тас); как было выявлено позже, они являются специфичными для ос-цепи рецептора к IL-2 (CD25).Заболевание вызывается человеческим Т-клеточным лимфотропным вирусом I типа из семейства ретровирусов (human Т cell lymphotropic virus 1 - HTLV-1), который был описан и выделен еще до открытия СПИДа и ВИЧ. Геномная структура провируса похожа на ВИЧ; она тоже содержит регион LTR и кодирует структурные и регуляторные белки, а также вирусные ферменты (обратную транскриптазу, интегразу и протеазу).
Вирусный белок Tax, который трансактивирует транскрипцию HTLV-1 путем связывания с областью LTR, активирует также и клеточные гены, в том числе те, которые кодируют IL-2, α-цепь IL-2R и гормон, подобный паратиреоидному (в обычных условиях не экспрессируется Т-клетками). Поэтому активация провирусной транскрипции связана с активацией и пролиферацией Т-клеток. У пациентов с ТЛЛВ часто отмечают значительно повышенную концентрацию кальция, что является результатом усиленного синтеза паратиреоидподобного гормона
Пути передачи HTLV-1 похожи на пути передачи ВИЧ в том смысле, что он передается через кровь и жидкости тела; наиболее эффективен путь передачи через грудное молоко. Поэтому многие пациенты инфицируются HTLV-1 в младенческом возрасте. Инкубационный период у этого вируса длительный, обычно 20 - 40 лет. В основном вирус инфицирует СD4+-Т-клетки, а также поражает нервную систему. У некоторых пациентов заболевание имеет клинические черты неврологического процесса.
Предметом продолжительной дискуссии является происхождение клеток Рид - Штернберга, поскольку они не экспрессируют маркеров никаких клеточных линий и характеризуются экспрессией только CD15 и CD30. В последних исследованиях с использованием молекулярных технологий была показана возможность реаранжировки генов lg, что подтверждает их происхождение из В-клеточной линии. Открытие гипермутации в генах иммуноглобулинов свидетельствует, что клетки Рид - Штернберга образовались из В-клеток, уже прошедших зародышевый центр. Хотя злокачественные клетки и были идентифицированы как В-клетки, по течению эти лимфомы отличаются от крупноклеточных В-клеточных лимфом, что и является причиной того, что их продолжают классифицировать как самостоятельную нозологию. Лимфомы, таким образом, подразделяют на лимфомы Ходжкина и неходжкинские.
Иммунотерапия
Увеличившиеся знания по биологии лимфом в сочетании с техническими возможностями производства моноклональных антител и белков привели к разработке нового поколения терапевтических средств. В настоящее время химерные и гуманизированные антитела, направленные, в частности, против CD20, широко используются в лечении В-клеточных лимфом. Если применяют только одни антитела («холодное» использование), они могут вызывать уничтожение опухолевых клеток путем их опсонизации при покрытии антителами, а в случае использования конъюгатов этих антител за непосредственное уничтожение клетки отвечают токсины.Кроме современной химиотерапии дополнительно используют вещества, блокирующие цитокины или цитокиновые рецепторы, необходимые для пролиферации злокачественных клеток. Традиционные средства химиотерапии, которые в основном являются неспецифическими веществами, уничтожают все делящиеся клетки. Технологии, использованные при разработке этих новых специфичных препаратов, также широко применяются при разработке средств для лечения аутоиммунных заболеваний и нелимфоидных онкологических заболеваний, таких как рак молочной железы.
Иммунная система в норме работает как тщательно отрегулированная сеть, отвечающая на патогенные факторы извне, но не причиняющая никакого вреда самой себе. Причем после того как угроза миновала, иммунная система возвращается в более спокойное состояние, но уже обладая памятью о произошедших событиях. Истощение , хроническая стимуляция или возможность неконтролируемого роста одного из компонентов нарушают работу оставшихся элементов. Таким образом, поскольку регулирование в сети нарушено, развитие каждого из трех главных категорий расстройств: иммунодефицита, аутоиммунного заболевания или лимфоидного новообразования, делает возможным развитие еще одного или даже двух типов заболеваний.
Выводы
1. Иммунодефицитные расстройства называются первичными, если причиной заболевания является дефицит, и вторичными, если недостаточность развивается вследствие других заболеваний или в результате лечения.2. Иммунодефицитные заболевания могут развиваться в результате нарушений развития или функционирования В-клеток, Т-клеток, фагоцитирующих клеток или компонентов комплемента.
3. Иммунодефицитные расстройства вызывают у пациентов предрасположенность к рецидивирующим инфекциям. Тип развивающейся инфекции обычно зависит от того, какое именно звено иммунной системы нарушено. Дефекты гуморального звена иммунитета приводят к повышенной восприимчивости к бактериальным инфекциям; дефекты в клеточно-опосредованном иммунитете - к вирусным и грибковым инфекциям; дефекты фагоцитирующих клеток - к инфекциям пиогенными микроорганизмами, а дефекты в системе комплемента - к бактериальным инфекциям и аутоиммунным расстройствам.
4. Иммунодефициты проявляются одним типом дефектов или расстройств иммунной системы. Другими типами иммунологических расстройств являются нерегулируемая пролиферация В- или Т-лимфоцитов, избыточное образование продуктов лимфоцитарных или фагоцитирующих клеток и нерегулируемая активация компонентов комплемента. Это может приводить к ассоциациям иммунодефицитов с аутоиммунными заболеваниями или злокачественными новообразованиями.
5. Инфицируя и уничтожая СD4+-лимфоциты, ВИЧ вызывает выраженное иммуносупрессивное заболевание, известное как СПИД.
6. Лимфоидные новоообразования иммунной системы развиваются в результате неконтролируемой моноклональной пролиферации, которую можно соотнести с развитием нормальных клеток на определенной стадии дифференцировки. При многих злокачественных лимфоидных новообразованиях обнаруживают специфические хромосомные транслокации, вызывающие нарушения регуляции процессов клеточной пролиферации или смерть. Некоторые из них связаны с инфекциями вирусами, такими как вирус Эпштейна-Барр и HTLV-1, выступающими или как стимуляторы клеточного роста, или как онкогенные вирусы.
Р.Койко, Д.Саншайн, Э.Бенджамини