Иммуногистохимическая диагностика рецепторного статуса рака молочной железы (PR, ER, ki67, Her2 neu). Лечение рака молочной железы, негативного по трем рецепторам Позитивный гормональный рецепторный статус соответствует 3 8
Читайте также
Гистологическое исследование ткани молочной железы является заключительным этапом в обследовании пациента. Данное исследование позволяет патоморфологу охарактеризовать структуру опухоли, - ее злокачественность или доброкачественность, и оценить ее биологические свойства, что позволяет клиницисту планировать дальнейшее лечение пациента и оценивать прогноз его заболевания.
Материал для гистологического исследования получают несколькими способами:
- путем аспирационной биопсии с помощью тонкой иглы, представляющей на исследование пунктат образования молочной железы
- путем инцизионной (ножевой) биопсии, представляющей на исследование фрагмент молочной железы
При изучении цитологических препаратов пунктата образования в молочной железе, либо при изучении фрагмента молочной железы патоморфолог выставляет окончательный диагноз. При этом аспирационное цитологическое исследование должно быть обязательно подтверждено гистологическим исследованием особенно в тех случаях, когда возникает необходимость проведения калечащей операции. Подобные исследования проводятся в момент операции (cito-диагностика) для определения объема операции и предварительного выбора терапии. После морфологической верификации диагноза РМЖ проводится плановое исследование удаленного фрагмента или всей ткани молочной железы с регионарными лимфоузлами.
При проведении патоморфологического исследования указывается детальная гистологическая характеристика опухоли и состояние регионарных лимфоузлов.
Гистологическая характеристика РМЖ включает:
- гистологическую форму опухоли (например, тубулярные, медуллярные, аденокистозные формы характеризуются более благоприятным прогнозом; раки с метаплазией, Педжета – менее благоприятным прогнозом);
- степень злокачественности или дифференцировки (опирается на степень структурного и клеточного атипизма, на выраженность пролиферативных процессов – при I степени злокачественности 5-летняя выживаемость составляет 75%, при II – 53%, при III – 31% соответственно);
- наличие или отсутствие круглоклеточной инфильтрации по периферии узла или в самом узле (инфильтрация отражает местную иммунную реакцию на рост опухоли);
- степень распространения (с акцентом на наличии опухолевых элементов в кровеносных и/или лимфатических сосудах, состоянии краев резекции);
- состояние регионарных лимфоузлов (главный дискриминирующий прогностический признак).
Анализ большого количества наблюдений показал, что гистоструктура РМЖ в определенной степени влияет на течение заболевания, однако высказаться об индивидуальном прогнозе на этом основании не представляется возможным. В настоящее время все большее значение, особенно при планировании адъювантной и неоадъювантной (предоперационной и постоперационной) терапии, приобретают свойства опухоли, представление о которых можно получить с помощью иммунохимическиих методов исследования.
Иммунохимические методы - основаны на реакции "антиген-антитело" в опухолевой ткани. Они позволяют определить рецепторы (антигены, тканевые маркеры) в определенных компонентах тканей, типах клеток и клеточных структурах. Различают:
- иммуногистохимический (ИГХ) метод - определяет экспрессию молекулярных маркеров на клеточном уровне, требует больших временных затрат, основной недостаток метода - потеря и маскировка антигена при приготовлении препарата, что возможно связано с использованием агрессивных химических реагентов при проводке и депарафинизации материала. Материал получают путем биопсии во время операции.
- иммуноцитохимический (ИЦХ) метод - также определяет экспрессию молекулярных маркеров на клеточном уровне, но не требует больших временных затрат, качественнее идентифицирует мембранные и цитоплазматические маркеры (чем ИГХ), что возможно связано со щадящей обработкой цитопрепаратов, отсутствием потери и маскировки антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов , для получения материала используется малотравматичная процедура (пункционная биопсия). Ограничение возможностей ИЦХ малым количество клеток или плохим качеством мазка решается использованием жидкостных систем накопления, что позволяет сохранить архитектонику клеток, расположить их монослоем, уменьшить фон и количество элементов крови в препарате, а также за счет концентрации клеток в одном месте значительно уменьшить расход реагента .
Сопоставление результатов экспрессии молекулярных маркеров при ИЦХ- и ИГХ-методах проводилось рядом исследователей . Получена хорошая корреляция: совпадение результатов ИЦХ- и ИГХ-исследований составило от 61 до 92% .
Тканевые маркеры, определяемые непосредственно в опухолевой ткани, отражают разные стороны и уровни функционирования клетки, специфику ее "поведения" и регуляции - например, гормональную чувствительность или склонность к инвазии и метастазированию. Харктеризуя биологические особенности опухоли, тканевые маркеры позволяют идивидуализировать лекарственную терапию, предсказать эффективность лечебных мероприятий и определить прогноз заболевания. В настоящее время в рутинной практике широко используются определение рецепторов к эстрогенам и прогестерону (ER, PR), her-2/neu (необходимы для назначения лечения) и ki 67 (вскрывает дополнительные свойства опухоли).
- Исследование рецепторов к стероидным гормонам - эстрогенам (РЭ) и прогестерону (РП).
Рецепторы стероидных гормонов представляют собой белки, специфически и избирательно связывающие соответствующие стероиды, после их проникновения в клетку и опосредующие их биологические эффекты. Присутствие РЭ в первичной опухоли молочной железы свидетельствует о ее потенциальной чувствительности к лечебным мероприятиям, направленным на противодействие эффектам эстрогенов. Считается, что наличие в опухоли рецепторов к эстрогенам (РЭ) и рецепторов к прогестерону (РП) свидетельствует о ее чувствительности к экзогенным гормонам и является прогностически благоприятным фактором. РП синтезируются в клетке под влиянием эстрогенов и, следовательно, являются показателем функциональной активности РЭ.
Содержание рецепторов эстрогена и прогестерона всегда выше в высокодифференцированных опухолях, а также у больных, находящихся в постменопаузе, по сравнению с женщинами репродуктивного и пременопаузального возраста. Известно, что при отсутствии гормонорецепторов в опухоли прогноз менее благоприятен и риск возникновения рецидивов выше. Показано, что в рецептор-негативных опухолях пролиферация опухолевых клеток в 10 раз активнее. В рецептор-положительных опухолях эстрогены тоже стимулируют процессы пролиферации, однако они не достигают уровня, свойственного рецептор-негативным опухолям.
Известно, что гормонозависимые опухоли молочной железы, содержащие оба или хотя бы один из рецепторов, имеют более благоприятное течение и лучший прогноз, независимо от проводимого адъювантного лечения, чем больные с рецептор-отрицательными опухолями. В.Ф. Семиглазов с соавт. (2001) установили, что опухоли, содержащие более 10% окрашенных на рецепторы к эстрогенам или прогестерону клеток, оказываются чувствительными к гормонотерапии. Больные, у которых опухоль не содержит рецепторов к стероидным гормонам, только в 5-10% случаев отвечают на гормональную терапию. У этих пациентов можно получить более выраженный лечебный эффект от цитостатической терапии.
Прогностическое значение рецепторного статуса опухоли отражает влияние эстрогенов на характер и течение заболевания. Известно, что РЭ(+)- опухоли обладают меньшей склонностью к прогрессированию, чем РЭ(-)- опухоли, но этот факт отчетливо проявляется лишь в первые годы наблюдения и заметно сглаживается к 10-летнему сроку.
Определение рецепторов к стероидным гормонам также важно для выбора тактики лечения и оценки эффективности проводимой гормонотерапии. Чувствительность опухоли к гормонам определяется сохранением в опухоли рецепторов, способных воспринять гормональный сигнал и транслоцировать его в ядро. Есть сведения о существовании различных форм рецепторов к эстрогенам и прогестерону: РЭ-альфа, РЭ-бета, РП-А и РП-B. Оба вида РЭ обладают практически одинаковым сродством к эстрадиолу. С присутствием РЭ-альфа в опухолях молочной железы связана чувствительность к тамоксифену. Рецепторы прогестерона, представленные изоформами А и В, играют различные роли в проникновении стероидов внутрь клетки. При наличии в опухоли рецепторов двух видов (РЭ и РП) эффективность метода гормонотерапии составляет 50–70%. Если присутствуют только рецепторы одного вида (РЭ или РП), то эффективность снижается до 33–39%.
- Определение факторов опухолевого роста и прогрессии
К факторам опухолевого роста относится HER-2/neu-белок (р185) (c-erb-B2), производство которого в норме строго регулируется геном HER-2/neu. Ген HER-2/neu локализуется в 17q-хромосоме и кодирует тирозинкиназный рецептор фактора роста, который расположен на поверхности клетки. В норме через НЕR-2/neu рецепторы организм контролирует процесс роста, деления и самовостановления здоровых клеток молочной железы. При нарушении регуляции ген HER-2/neu производит слишком много одноименных рецепторов и после связывания их с белком HER-2/neu клетка получает сигнал на неконтролируемый рост и деление, и превращается в раковую. Повышенное содержание белка HER-2/neu(р185) и амплификация гена HER-2/neu с повышенной выработкой рецептора HER-2/neu характеризует HER-2 позитивный рак молочной железы. Рак молочной железы с нормальным содержанием гена HER-2/neu, рецептора HER-2/neu и белка HER-2/neu(р185) называется HER-2 - негативным.
HER-2 позитивный рак молочной железы отличается агрессивным течением, растет и распространяется быстрее, чем HER-2 негативный рак молочной железы. Блокирование HER-2/neu может существенно замедлить или остановить рост опухолей, однако эффективное использование биологически активных препаратов предусматривает предварительную оценку индивидуальной чувствительности больных к данному виду лечения, включающую использование иммуногистохимического окрашивания опухолевых тканей на белок HER-2/neu (р185) с последующей оценкой амплификации гена c-erbB-2 методом флуоресцентной гибридизации in situ (FISH).
При HER-2 позитивном раке молочной железы назначают лекарственный препарат Herceptin (гуманизированное моноклональное антитело к HER-2/neu), который связывается с HER-2/neu и блокирует экспрессию этого фактора, что существенно снижает опухолевый рост и, соответственно, улучшает прогноз пациента. В связи с тем, что препарат обладает высокой кардиотоксичностью, его назначение должно быть сопряжено с выявлением экспрессии онкогена HER-2/neu.
Существуют четыре способа определения HER-2 статуса рак молочной железы:
- иммуногистохимический
[показать]
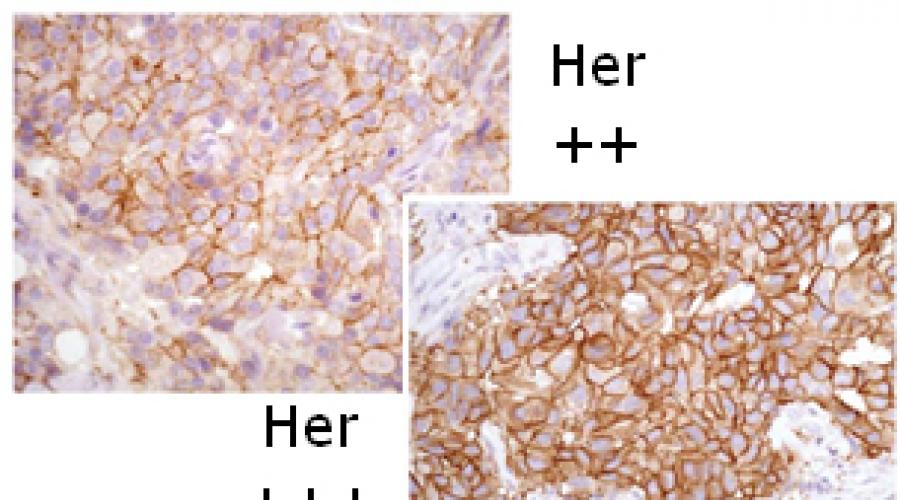
Иммуногистохимия (ИГХ) - это наиболее дешевый и наименее точный способ определения HER-2 статуса.
Исследуется гистологический материал, полученный при биопсии рака молочной железы. Иммуногистохимическое исследование определяет количество HER-2 протеина в клетках опухоли молочной железы c помощью специальной окраски. Чем больше HER-2 рецепторов содержится в исследуемом образце рака молочной железы, тем сильнее окраска. Выраженность окраски оценивается по шкале от 0 до 3+.
Результаты иммуногистохимического иследования HER-2 статуса рака молочной железы интерпретируют следующим образом: 0: HER-2 - отрицательный рак молочной железы, лечение Герцептином не показано 1+ или +: HER-2 - отрицательный рак молочной железы, возможно проведение дополнительного FISH исследования для перепроверки HER-2 статуса; 2+ или ++: пограничное значение, неясный случай, обязательна перепроверка HER-2 статуса с пощью FISH исследования; 3+ или +++: HER-2 - положительный рак молочной железы, показано лечение Герцептином.
Точность иммуногистохимии ниже, чем FISH так-как зависит от человеческого фактора, субъективного восприятия результатов окраски препарата врачом-гистологом. К тому же, в разных лабораториях приняты разные критерии оценки выраженности окраски ткани при ИГХ.
- FISH
[показать]
FISH исследование определяет есть ли повышенное количество (амплификация) гена HER-2 в клетках опухоли молочной железы. FISH - более точное и дорогое исследование, чем ИГХ.
Результаты FISH теста выражаются следующим образом: HER-2 - позитивный рак молочной железы (есть амплификация гена HER-2); HER-2 - негативный рак молочной железы (нет амплификации гена HER-2).
- SPoT-Light HER-2 CISH тест
[показать]
SPoT-Light HER-2 CISH определяет есть повышенное количество (амплификация) гена HER-2 в клетках опухоли молочной железы. Применятся с 2008 года.
Результаты SPoT-Light HER-2 CISH теста формулируют следующим образом: HER-2 - позитивный рак молочной железы (есть амплификация гена HER-2), показано лечение Герцептином; HER-2 - негативный рак молочной железы (нет амплификации гена HER-2), лечение Герцептином не показано.
- Inform HER-2 Dual ISH тест
[показать]
Inform HER-2 Dual ISH тест - новый тест разрешенный к применению в США с июня 2011 года. Не требует применения флуоресцентного микроскопа. Inform HER-2 Dual ISH исследование определяет есть повышенное количество (амплификация) гена HER-2 в клетках опухоли молочной железы.
Результаты SPoT-Light HER-2 Inform HER-2 Dual ISH теста выражаются следующим образом: HER-2 - позитивный рак молочной железы (есть амплификация гена HER-2), показано лечение Герцептином и Тайвердом; HER-2 - негативный рак молочной железы (нет амплификации гена HER-2), лечение Герцептином и Тайвердом не показано.
Исследования показывают, что со временем у некоторых пациентов HER-2 - положительный рак молочной железы может трансформироваться в HER-2 - отрицательный. У пациентов с HER-2-негативной формой заболевания Герцептин не эффективен.
- иммуногистохимический
[показать]
- Определение пролиферативной активности опухолевых клеток
Маркер пролиферации Ki-67 позволяет определить "скрытый" пролиферативный потенциал опухоли (скорость деления опухолевой клетки) и судить о степени злокачественности. Выявляет только делящиеся клетки. Позитивная реакция с Ki-67 имеет обратные отношения с рецепторным статусом и является предсказательным фактором для лучевой и химиотерапии.
Пролиферативная активность в опухолях молочной железы в соответствии с рекомендациями M.D. Fitzgibbons et al. оценивается по градациям (≥ 1%, ≥ 10%, ≥ 20% опухолевых клеток), в связи с чем экспрессия Ki-67 более чем в 20% опухолевых клеток рассматривается как высокоагрессивная опухоль с более высокой вероятностью ответа на химиотерапевтическое лечение. При низком уровне Ki-67 и наличии позитивных рецепторов к эстрогенам и прогестерону, опухоль в большей мере отреагирует на гормонотерапию.
Описанный набор тканевых маркеров в настоящее время определяется рутинно при исследование ткани молочной железы. Однако существует и огромное количество тканевых маркеров, которые пока еще не доступны широкой практике в силу высокой стоимости, а также недостаточного исследования их диагностического значения. Одной из задач патоморфологов и клиницистов, работающих в области онкопатологии, как раз и является определение того набора наиболее значимых, дополняющих друг друга показателей, который бы позволил при минимально возможной стоимости обследования обеспечить максимальную эффективность лечения каждого пациента. Спектр исследования в каждом конкретном случае может зависеть от стадии заболевания, возраста пациентки, планируемой терапии и материально-технической базы учреждения.
Литература [показать]
- Prognostic Factors in Breast Cancer / M.D. Fitzgibbons et al. // Arch. Pathol. Lab. Med.- 2000.- Vol. 124.- P. 966–978.
- Ki-67 immunostaining in 322 primary breast cancers: association with clinical and pathological variables and prognosis / A. Molino, R. Micciolo, M. Turazza et al. // Int. J. Cancer.- 1997.- Vol. 74.- P. 433–437.
Обязательным является определение статуса эстрогеновых и прогестероновых рецепторов, оптимальным является метод иммуногистохимии.
Одновременно проводится иммуногистохимическое определение экспрессии HER2-рецепторов для выбора дальнейшего лечения.
Данное исследование поддержано Представительством фармацевтической компании "Hoffman-La Roche" в Армении.
 В случае, если это исследование дает результат (++), необходимо провести определение амплификации HER2 гена методами флюоресцентной (FISH) или хромогенной гибридизации in situ (CISH).
В случае, если это исследование дает результат (++), необходимо провести определение амплификации HER2 гена методами флюоресцентной (FISH) или хромогенной гибридизации in situ (CISH).
Что такое рецепторы к эстрогенам и прогестерону?
Рецепторы к эстрогенам и прогестерону являются белковыми молекула¬ми, которые располагаются на поверхности опухоли. Эстрогены и прогестерон, которые вырабатываются в организме человека, соединяются с этими рецепторами. В результате происходит стимуляция роста опухоли.
Как определить наличие рецепторов к эстрогенам и прогестерону?
Материалом для исследования является опухоль (полученная после операции) или ее часть (после биопсии).
Метод: иммуногистохимическое окрашивание (ИГХ).
Зачем определять ЭР и ПР?
Определение рецепторов к эстрогенам и прогестерону является одной из важнейших диагностических мер, позволяющих определять чувствительность опухоли к гормоноте¬рапии. Рецепторный статус является важнейшим фактором в определении риска развития рецидива рака молочной железы.
 Где можно определить ЭР и ПР?
Где можно определить ЭР и ПР?
В Центре Медицинской генетики и первичной охраны здоровья проводится определение рецепторного статуса. В настоящее время в Ереване существует только одна лаборатория, в которой проводится исследование на содержание эстрогеновых и прогестероновых рецепторов. Если вам необходимо определение рецепторов вы можете обратиться к нам.
При проведении иммуногистохимического окрашивания нами используются реактивы фирмы ДАКО (Дания), являющейся признанным лидером в данной области во всем мире.
Как часто встречаются гормональные рецепторы на поверхности клеток РМЖ?
- Около 75% всех раковых опухолей молочной железы являются гормонально-позитивными в плане эстрогеновых рецепторов (Эр-положительные).
- Около 65% из этих гормонально-позитивных опухолей имеют на поверхности и прогестероновые рецепторы (Пр-положительные).
- Около 25% всех раковых опухолей молочной железы являются гормонально-негативными как в плане эстрогена, так и прогестерона.
- Около 10% всех раковых опухолей молочной железы являются гормонально-позитивными в плане эстрогеновых рецепторов и негативными в плане прогестероновых рецепторов.
- Около 5% всех раковых опухолей молочной железы являются гормонально-негативными в плане эстрогеновых рецепторов и позитивными в плане прогестероновых рецепторов.
Цель исследования - изучить прогностическое значение рецепторного статуса опухолей при раннем раке молочной железы (I стадии). Материалы и методы. Проведен ретроспективный анализ историй болезни 1036 пациенток с ранним раком молочной железы (T1N0M0-стадии), которые получили лечение в РОНЦ им. Н.Н. Блохина РАМН и Клинике РМАПО с 1985 по 2009 гг. Изучено прогностическое значение рецепторов эстрогенов (ER), прогестерона (PR) и HER2, а также прогностическое значение гиперэкспрессии HER2 при раннем раке молочной железы как в самостоятельном варианте, так и в сочетании с рецепторами стероидных гормонов. Результаты. На основании сочетания рецепторов выделены иммуногистохимические подтипы рака молочной железы: люминальный А и В, тройной негативный рак и рак с гиперэкспрессией HER2. Установлено, что самостоятельного прогностического значения наличие или отсутствие рецепторов стероидных гормонов ER и PR в опухоли при раннем раке молочной железы не имеет. Гиперэкспрессия HER2 является не прогностическим признаком при анализе общей выживаемости, но неблагоприятным фактором для безрецидивной выживаемости как в самостоятельном варианте, так и в комбинациях с рецепторами стероидных гормонов.
СвернутьРак молочной железы , рецепторный статус опухоли er pr her2 , иммуногистохимические подтипы рака молоч- ной железы
Короткий адрес: https://сайт/14316692
IDR: 14316692
Список литературы Прогностическое значение рецепторного статуса опухоли при раннем раке молочной железы
- Alan S. Coates, Marco Colleoni, Aron Goldhirsch. Is adjuvant chemotherapy useful for women with luminal a breast cancer? Journal of Clinical Oncology 2012; 30: 1-4.
- Islam T., Matsuo K., Ito H., Hosono S., Watanabe M., Iwata H., Tajima K., Tanaka H. Reproductive and hormonal risk factors for luminal, HER2-overexpressing, and triple-negativebreast cancer in Japanese women. Ann Oncol 2012 Sept; 23(9): 2435-2441.
- Kwon M.J., Park S., Choi J.Y., Oh E., Kim Y.J., Park Y.H., Cho E.Y., Kwon M.J., Nam S.J., Im Y.H., Shin Y.K., Choi Y.L. Clinical significance of CD151 overexpression in subtypes of invasive breast cancer. Br J Cancer 2012 Feb 28; 106(5): 923-930.
- Xie W., Yang J., Cao Y., Peng C., Ning H., Zhang F., You J. Expression of Y-Box-binding protein 1 in Chinese patients with breast cancer. Tumour Biol 2012 Feb; 33(1): 63-71.
- Oliveira-Costa J.P., Zanetti J.S., Silveira G.G., Soave D.F., Oliveira L.R., Zorgetto V.A., Soares F.A., Zucoloto S., Ribeiro-Silva A. Differential expression of HIF-1a in CD44+CD24-/low breast ductal carcinomas. Diagn Pathol 2011 Aug 8; 6: 73.
- Kim S.R., Paik S. Genomics of adjuvant therapy for breast cancer. Cancer J 2011 Nov-Dec; 17(6): 500-504.
- Lu M., Li B., Li Y., Mao X., Yao F., Jin F. Predictive role of molecular subtypes in response to neoadjuvant chemotherapy in breast cancerpatients in northeast china. Asian Pac J Cancer Prev 2011; 12(9): 2411-2417.
- Cheang M.C., Chia S.K., Voduc D., Gao D., Leung S., Snider J., Watson M., Davies S., Bernard P.S., Parker J.S., Perou C.M., Ellis M.J., Nielsen T.O. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst 2009 May 20; 101(10): 736-750.
- Pazaiti A., Fentiman I.S. Basal phenotype breast cancer: implications for treatment and prognosis. Womens Health (Lond Engl) 2011 Mar; 7(2): 181-202.
- Tran B., Bedard P.L. Luminal-B breast cancer and novel therapeutic targets. Breast Cancer Res 2011 Nov 30; 13(6): 221.
- Arnes J.B., Bgin L.R., Stefansson I., Brunet J.S., Nielsen T.O., Foulkes W.D., Akslen L.A. Expression of epidermal growth factor receptor in relation to BRCA1 status, basal-like markers and prognosis in breast cancer. J Clin Pathol 2009 Feb; 62(2): 139-144.
- Gucalp A., Traina T.A. Triple-negative breast cancer: adjuvant therapeutic options. Chemother Res Pract 2011; р. 696208.
- Collins L.C., Martyniak A., Kandel M.J., Stadler Z.K., Masciari S., Miron A., Richardson A.L., Schnitt S.J., Garber J.E. Basal cytokeratin and epidermal growth factor receptor expression are not predictive of BRCA1 mutation status in women with triple-negative breast cancers. Am J Surg Pathol 2009 Jul; 33(7): 1093-1097.
3205 0
Срок возникновения локальных рецидивов (ЛР) (время от радикально выполненной операции до возникновения рецидивной опухоли) является важным прогностическим фактором для больных раком молочной железы (РМЖ) .
Около 75% всех ЛР возникают в первые 5 лет после перенесенной операции, хотя в литературе описаны уникальные случаи возникновения поздних локальных рецидивов в области грудной стенки у пациенток, перенесших мастэктомию: у 77-летней пациентки спустя 23 года и у 90-летней женщины спустя 40 лет после перенесенной операции.
Использование возможностей современного морфологического исследования опухолей позволило подтвердить развитие именно ЛР первичной опухоли.
По нашим данным (архив РОНЦ им. Н.Н. Блохина РАМН), максимальный срок возникновения рецидива составляет 18 лет.
Клинический пример
В 1978 г. по поводу рака правой молочной железы T2N1M0 больной в возрасте 32 лет выполнена радикальная мастэктомия (РМЭ) (по Пейти), в адъювантном режиме проведена химиотерапия тиосроссрамидом в дозе 120 мг.Спустя 18 лет после операции у больной появилось опухолевидное уплотнение в средней трети послеоперационного рубца. При дообследовании [маммография и ультрозвуковое исследование (УЗИ) левой молочной железы, рентгенография органов грудной клетки, УЗИ органов брюшной полости и малого таза, сцинтиграфия скелета] какой-либо другой опухолевой патологии у больной не выявлено.
По данным УЗИ: в средней трети послеоперационного рубца определяется опухолевый узел округлой формы с нечеткими контурами, размером 1,2х0,9 см, с инвазией в межреберье (рис. 7).
Рис. 7. УЗ-картина ЛР в области послеоперационного рубца с инвазией опухоли в межреберье.
С целью верификации диагноза выполнена пункция опухолевого узла. Цитологическое заключение - рак; при сравнении пунктатов цитограммы первичной опухоли и локальных рецидивов идентичны.
Больной проведена лучевая терапия на область послеоперационного рубца и регионарные зоны метастазирования, разовая очаговая доза (РОД) 2 Гр, суммарная очаговая доза (СОД) 50 Гр, с полным эффектом. С учетом рецепторного статуса опухоли (опухоль экспрессирует рецепторы эстрогена (РЭ) +рецепторы прогестерона (РП) +) рекомендован прием тамоксифена 20 мг/сут. Больная прослежена в течение 2 лет - признаки прогрессирования заболевания отсутствуют.
В мировой литературе выделены понятия раннего и позднего ЛР РМЖ. Понятие "ранний локальный рецидив" различно у разных авторов - от 2 до 4 лет после операции; развитие рецидива в эти сроки ассоциировано с повышенным риском отдаленного метастазирования и смерти от прогрессирования болезни. Различия в показателях общей выживаемости среди пациенток с ранними и поздними рецидивами представлены в табл. 9.
Таблица 9. Показатели общей выживаемости у больных с ранними и поздними ЛР рака молочной железы
| Источник | Число больных |
Срок возникновения
локальных рецидивов РМЖ, мес после операции |
Общая выживаемость больных при рецидивах, % | ||
| ранний | поздний | ранний | поздний | ||
| A. Courdi и соавт. | 180 | До 36 | Позже 60 | 55,8 | 79,5 |
| J. Fodor | 68 | До 24 | Позже 24 | 25 | 72 |
| A. Neri и соавт. | 46 | До 24 | Позже 24 | 10 | 87,5 |
Авторы подчеркивают, что срок возникновения ЛР коррелирует с такими факторами, как: пременопаузальный статус, размер опухоли более 2 см, степень злокачественности опухоли, наличие лимфоваскулярной инвазии, отрицательный статус рецептором эстрогена и мультицентричность роста опухоли.
Кроме того, выявлена корреляция раннего срока возникновения рецидива с поражением аксиллярных лимфатических узлов, а также низкой степенью дифференцировки и РЭ(-)-статусом первичной опухоли, что определяет более неблагоприятный прогноз у этих больных.
Ранние рецидивы рака молочной железы
Ранние рецидивы после операции у больных раком молочной железы представляют особый клинический интерес. С одной стороны, ранние рецидивы после операций всегда вызывают сомнение в отношении радикальности выполненного хирургического вмешательства.С другой стороны, возникновение рецидива в ранние сроки после операции на фоне проводимой адъювантной терапии может являться показателем устойчивости опухолевых клеток к проводимому лекарственному и лучевому лечению, что требует пересмотра режимов стандартной терапии и выработки индивидуального, нередко нестандартного лечебного подхода.
Мы изучили срок возникновения ЛР как самостоятельный прогностический фактор у 116 пациенток с первично-операбельным РМЖ (T1-3N0-1 стадии), получивших лечение в РОНЦ им. Н.Н. Блохина РАМН с 1990 по 2006 г. ЛР возникли в срок от 4 мес до 10 лет после радикальной операции (мастэктомии в модификации по Маддену или радикальной резекции молочной железы со стандартной аксиллярной лимфаденэктомией).
Среднее время возникновения локальных рецидивов составило 41,4±2,6 мес (от 4 мес до 10 лет). Максимальный риск возникновения ЛР нами отмечен на 2-м году после операции (29,3%) и минимальный - на 7-м году (1,7%). В срок до 5 лет реализовалось большинство ЛР (79,3%; рис. 8).

Рис. 8. Частота возникновения ЛР в различные сроки после операции.
По сроку возникновения локальных рецидивов мы разделили пациенток на 3 условные группы: группу раннего ЛР (рецидив возник в срок до 30 мес после операции) - 54 случая, 46,6%; промежуточную группу (рецидив от 30 до 60 мес после операции) - 38 больных, 32,8%; группу позднего локального рецидива (спустя 60 мес после операции) - 24 пациентки, 20,6% (рис. 9).

Рис. 9. Распределение больных по сроку возникновения ЛР РМЖ.
Такое распределение пациенток было неслучайным. Нами выполнен многофакторный статистический анализ, на основании которого выявлено принципиальное сходство (по факторам риска возникновения рецидивов, клинико-морфологическим проявлениям и прогнозу заболевания) характеристик пациенток со сроком возникновения ЛР до 30 мес; аналогичные данные получены и для пациенток со сроком возникновения ЛР спустя 60 мес. Это послужило основанием для предпринятого деления больных.
Для выполнения однофакторного статистического анализа мы использовали пакет прикладных программ STATISTICA 6; непараметрические данные в зависимости от количества наблюдений анализировали с использованием теста хи-квадрат или точного критерия Фишера.
Различия считались статистически достоверными при р
При однофакторном анализе мы выявили факторы, коррелирующие со сроком возникновения ранних ЛР (табл. 10).
Таблица 10. Факторы, коррелирующие со сроком возникновения ЛР (однофакторный анализ; р
Необходимо отметить, что в результате анализа нами не отмечено статистически достоверной зависимости (р>0,05) срока возникновения рецидива и таких показателей, как внутрипротоковый компонент, мультицентричность опухоли, лимфоидная инфильтрация стромы опухоли, локализация опухоли, сторона поражения, степень злокачественности опухоли и наличие поражения регионарных лимфатических узлов.
При многофакторном анализе (по методу Байеса с анализом 60 признаков) выделены факторы, обладающие максимальной прогностической значимостью для риска возникновения раннего локального рецидива: рецепторный статус первичной опухоли и тактика лечения.
Рецепторный статус первичной опухоли имеет важное прогностическое значение для срока возникновения ЛР. Мы выявили отчетливое преобладание рецептороотрицательных опухолей у пациенток с ЛР: РЭ(-)-опухоли у 56,4%, РП(-)-опухоли имели 55% больных, более четверти всех пациенток имели РЭ(-)РП(-)-опухоли, РЭ(+)РП(+)-опухоли были диагностированы только у 16% больных. Такая высокая частота рецептороотрицательных опухолей нехарактерна для общей группы пациенток с первично-операбельным РМЖ.
Кроме того, при РЭ(+)РП(+)-статусе первичной опухоли среднее время возникновения рецидива составляет 53,9 мес, доля ранних рецидивов минимальна - 37,5%; у больных с рецептороотрицательными опухолями среднее время возникновения рецидива короче на 14 мес (39,8 мес), доля ранних рецидивов значительно выше - 59,3%, р
Таблица 11. Сроки возникновения ЛР при различном рецепторном статусе опухоли
|
Рецепторный статус первичной опухоли
|
Число больных (n=101) | Средний срок рецидива, мес | Срок возникновения рецидивов, % больных | |||
| абс. | % | до 30 мес | 30-60 мес | спустя 60 мес | ||
| РЭ(+)РП(+) | 16 | 15,8 | 53,9* | 37,5* | 25* | 37,5* |
| РЭ(+)РП(-) | 8 | 7,9 | 45,4 | 37,5 | 50 | 12,5 |
| РЭ(-)РП(+) | 12 | 11,9 | 38,3 | 58,3 | 16,7 | 25 |
| РЭ(-)РП(-) | 26 | 25,7 | 39,8* | 59,3* | 14,8* | 25,9* |
| РЭ(+)РП не известны | 20 | 19,8 | 42,9 | 30 | 50 | 20 |
| РЭ(-)РП не известны | 19 | 18,8 | 35,8 | 50 | 38,9 | 11,1 |
Необходимо отметить, что РЭ(-)-опухоли ассоциировались с другими прогностически неблагоприятными факторами: возрастом до 35 лет (р=0,03), размером опухоли более 2 см (р=0,01) и поражением аксиллярных лимфатических узлов (р
Статус рецепторов прогестерона является самостоятельным фактором, не коррелирующим с возрастом больных: во всех возрастных группах несколько преобладали РП(-)-опухоли. Статус рецепторов прогестерона ассоциирован с размером первичной опухоли: опухоли небольшого размера (Т1) чаще являлись рецептороположительными (58%), а опухоли размера Т2 чаще были рецептороотрицательными (67%; р=0,02). Поражение аксиллярных лимфатических узлов также ассоциировалось с РП(-)-статусом опухоли (р=0,001).
Нами не отмечено статистической корреляции между статусом рецепторов стероидных гормонов опухоли и такими показателями, как мультицентричность, внутрипротоковый компонент, наличие раковых эмболов и лимфоидная инфильтрация стромы опухоли.
Анализ зависимости возникновения локальных рецидивов
При анализе зависимости срока возникновения локальных рецидивов от объема перенесенной операции было выявлено, что среднее время возникновения ЛР после РМЭ меньше, чем после радикальной резекции (33,1 мес по сравнению с 48 мес; р=0,01), доля ранних рецидивов выше в группе пациенток, перенесших мастэктомию по сравнению с пациентками, перенесшими радикальную резекцию молочной железы (59,2% против 37,9%). Эти неожиданные факты нашли простое объяснение при сравнении клинических ситуаций, определяющих выбор тактики лечения.РМЭ чаще выполнялась у пациенток в менопаузе, а у пациенток более молодого возраста с сохраненной менструальной функцией, чаще выполнялась радикальная резекция молочной железы.
Важно отметить, что РМЭ чаще выполнялась при размере опухоли Т2 и при поражении регионарных лимфатических узлов, а органосохраняющие операции - при размере опухоли Т1 и отсутствии поражения лимфатических узлов, что подтверждено данными планового морфологического исследования. Кроме того, большинству больных после ор ганосохраняющих операций проведена адъювантная лучевая терапия, что не отмечено в группе мастэктомий (табл. 12).
Таблица 12. Выбор объема операции в различных клинических ситуациях
| Фактор | Радикальная мастэктомия, 49 (42,2%) больных | Радикальная резекция, 67(57,8%) больных | ||
| абс. | % | абс. | % | |
|
Возраст, годы: |
||||
| до 35 лет | 3 | 6,1 | 6 | 9 |
| от 36 до 50 лет | 14 | 28,6* | 37 | 54,6* |
| старше 51 года | 32 | 65,3* | 24 | 36,4* |
| Менопауза | 34 | 69,4* | 26 | 39,4* |
| Менструальная функция сохранена | 15 | 30,6* | 41 | 60,6* |
|
Размер опухоли: |
||||
| Т1 | 12 | 24,5* | 39 | 57,6* |
| Т2 | 36 | 73,5* | 27 | 40,9* |
| Т3 | 1 | 2 | 1 | 1,5 |
|
Поражение аксиллярных лимфоузлов: |
||||
| есть | 28 | 57,1* | 16 | 24,3* |
| нет | 21 | 42,9* | 51 | 75,7* |
|
Послеоперационная лучевая терапия: |
||||
| не применялась | 43 | 87,8* | 19 | 28,8* |
| применялась | 6 | 12,2* | 48 | 71,2* |
* Значения, различающиеся статистически достоверно, р
Мы изучили срок возникновения ЛР как самостоятельный независимый фактор у больных раком молочной железы. Необходимо отметить, что 25% пациенток перенесли только хирургическое лечение первичной опухоли (одинаково часто мастэктомию и резекцию железы), в этой группе преобладали больные в менопаузе (59%), с левосторонней локализацией опухоли (66%) и РЭ(-)РП(-)-статусом опухоли (69%).
Выполнение только хирургического лечения первичной опухоли негативно отразилось на сроке возникновения ЛР: доля ранних рецидивов крайне высока - 69%, среднее время возникновения рецидивов составило всего 29 мес.
Комбинированное лечение операция + лучевая терапия проведено 22,4% больных (чаще после органосохраняющего лечения - 88%, пациенткам с сохраненной менструальной функцией - 81%, с правосторонней локализацией опухоли - 62%, при размере опухоли Т1 - 62% и отсутствии поражения лимфатических узлов - 96%).
В этой группе доля ранних рецидивов значительно меньше и составляет 38,5%, средний срок возникновения рецидивов - 43 мес. Мы отметили важную закономерность: среди пациенток, получивших лучевую терапию в СОД более 50 Гр (8 случаев), не отмечено ни одного случая возникновения ранних рецидивов, однако небольшое число наблюдений ограничивает оценку статистической значимости данного фактора.
Комбинированное лечение операция + химиотерапия проведено 12,9% больных (после мастэктомии - в 80% случаев, при размере первичной опухоли Т2 - в 67% и при поражении регионарных лимфатических узлов - в 93%).
Наличие таких неблагоприятных характеристик повлияло на срок возникновения локальных рецидивов: средний срок возникновения рецидива составил 28,5 мес, доля ранних рецидивов высока - 73,3%. Нами выявлено, что срок возникновения ЛР не коррелирует с количеством курсов адъювантной химиотерапии: увеличение числа курсов химиотерапии с 4 до 6 не приводит к увеличению срока возникновения ЛР.
Комбинированное лечение операция + гормонотерапия проведено 10,3% больных (в менопаузе - 100%, после мастэктомий - 75%, при рецептороположительном статусе опухоли - 92% случаев). Средний срок возникновения рецидивов в этой группе составил 46,2 мес, доля ранних рецидивов равна 33,3%.
Максимальное среднее время возникновения рецидивов (54,6 мес) и самую низкую долю ранних рецидивов (26,5%) мы выявили среди пациенток, получивших комплексное лечение первичной опухоли (29,3%). Следует подчеркнуть, что комплексное лечение первичной опухоли получали пациентки вне зависимости от возраста, менструального статуса, стороны поражения, размера и рецепторного статуса опухоли, достоверно чаще после органосохраняющего лечения при наличии поражения регионарных лимфатических узлов (р=0,04; табл. 13).
Таблица 13. Сроки возникновения ЛР при различной лечебной тактике
| Тактика лечения | Средний срок возникновения рецидива, мес | Группа рецидивов | Всего | ||
| до 30 мес (n= 54) | от 30 до 60 мес (n= 38) | спустя 60 мес (n=24) | |||
| Операция | 29,2* | 20 (68,9)* | 5 (17,2)* | 4 (14,5)* | 29 |
| В том числе: |
|
|
|
|
|
| мастэктомия | 26,8 | 10 | 2 | 2 | 14 |
| резекция | 31,4 | 10 | 3 | 2 | 15 |
| Операция + ЛТ | 43 | 10 (38,5) | 11 (42,3) | 5 (19,2) | 26 |
| Операция + ХТ | 28,5 | 11 (73,3) | 3 (20) | 1 (6,7) | 15 |
| Операция + ГТ | 46,2 | 4 (33,3) | 6 (50) | 2 (16,7) | 12 |
| Комплексное лечение | 54,6* | 9 (26,5)* | 13 (38,2)* | 12 (35,3)* | 34 |
Примечание: * Начения, различающиеся статистически достоверно; р химиотерапия; ГТ - гормонотерапия. В скобках - процент больных.
При многофакторном анализе мы выявили, что независимыми факторами прогноза для срока возникновения локальных рецидивов при первично-операбельном РМЖ являются: рецепторный статус первичной опухоли и применяемая тактика лечения; при выполнении только хирургического лечения у пациенток с рецептороотрицательными опухолями риск раннего ЛР достигает 75%.
Таким образом, у пациенток с первично-операбельным раком молочной железы возможно возникновение ЛР в различные сроки после радикального удаления первичной опухоли, однако максимальный риск пациентки имеют на 2-м году после операции, минимальный - на 7-м году, в срок до 5 лет реализуется большинство локальных рецидивов (79%).
Частота возникновения ЛР зависит от объема перенесенной операции, стадии болезни и применения послеоперационной лучевой терапии: у пациенток после мастэктомии она составляет 3,3% (вне зависимости от факта применения лучевой терапии), после органосохраняющих операций без лучевого лечения - 7,4% и у пациенток, перенесших радикальные резекции железы и адъювантную лучевую терапию , - 3,3%. Частота возникновения ЛР четко коррелирует со стадией болезни: не превышает 4% при Т1-2N0-1 и достигает 8,3% при Т3N0-1.
Рецепторный статус первичной опухоли и используемая тактика лечения являются важнейшими факторами прогноза для срока возникновения раннего ЛР. Возможно прогнозирование срока возникновения локальных рецидивов: при сочетании только хирургического лечения болезни и рецептороотрицательного статуса первичной опухоли риск возникновения ЛР в первые 30 мес после операции достигает 75%, что необходимо учитывать при планировании адекватного лечебного алгоритма для больных РМЖ.
И.В. Поддубная, Д.В. Комов, И.В. Колядина
Иммуногистохимическая диагностика рецепторного статуса рака молочной железы (PR, ER, ki67, Her2 neu) – исследование биоптата ткани, меченого антителами, под микроскопом. Анализ выполняется для определения рецепторного статуса рака молочной железы.
ИГХ-исследования проводят после выполнения гистологического исследования.
Иммуногистохимические исследования
Иммуногистохимические исследования – вид морфологического исследования тканей, полученных в ходе биопсии, и меченых специфическими антителами. В основе метода лежит принцип взаимодействия «антиген-антитело». Ткань, в которой происходит патологический процесс, экспрессирует антигены. При нанесении на образец ткани антител, образуется комплекс антиген-антитело. Благодаря меткам, он становится доступным для визуализации. Врач-патоморфолог изучает количество клеток, окрашенных маркером. Он определяет в исследуемой ткани локализацию клеток, гормонов и их рецепторов, ферментов, иммуноглобулинов, компонентов клеток и отдельных генов.
Иммунногистохимическое исследование определяет характер иммунологических нарушений. Анализ выявляет пациенток с аутоиммунным воспалением и аутоиммунным ответом в эндометрии, что определяет тактику их ведения.
Рак молочной железы (РМЖ) - злокачественная опухоль железистой ткани молочной железы. РЖМ занимает первое место среди всех злокачественнsх заболеваний у женщин.
В зависимости от наличия биологических маркеров опухоли - экспрессии гормональных рецепторов (эстрогена и/или прогестерона), экспрессии HER2 - выделяют гормон-рецептор-положительный, HER2-положительный и тройной негативный РМЖ.
- HER2/neu-положительные (HER2+) типы рака молочной железы отличаются высокой экспрессией белка HER2/neu;
- HER2/neu-негативные (HER2-) типы рака молочной железы отличаются низкой экспрессией или отсутствием белка HER2/neu/
HER2 - рецептор эпидермального фактора роста человека 2-го типа, который присутствует в тканях и в норме, участвуя в регуляции деления и дифференцировки клеток. Его избыток на поверхности опухолевых клеток (гиперэкспрессия) предопределяет быстрый неконтролируемый рост новообразования, высокий риск метастазирования, низкую эффективность некоторых видов лечения. HER2-положительный РМЖ является особенно агрессивной формой данного заболевания, поэтому точное определение HER2-статуса имеет ключевое значение для выбора тактики лечения.
Рецепторы к эстрогену (ER) и прогестерону (PR)
Эстроген и прогестерон - основные женские половые гормоны. Они вырабатываются яичниками и являются основными регуляторами деятельности репродуктивной системы женщины.
Рецепторы присутствуют в различных тканях, в том числе в молочных железах и матке.
Рецепторы к эстрогену (ER) и прогестерону (PR) являются веществами белковой природы, которые локализованы на поверхности опухолевой клетки. Под влиянием женских половых гормонов, рецепторы формируют комплекс, который стимулирует появление новых опухолевых клеток. Разрушение этого механизма лежит в основе гормонотерапии.
Иммуногистохимическое определение ER и PR способно повести дифференциальную диагностику характера опухоли, выявить чувствительность опухоли к гормонам. Анализ позволяет скорректировать и уточнить лечение, а также оценить эффективность.
Опухоли с высоким содержанием рецепторов к эстрогенам и прогестерону являются высокодифференцированными. Они обладают низкой пролиферативной активностью и характеризуются не агрессивным течением. Опухоли с такими показателями хорошо отвечают на гормональную терапию и имеют хороший прогноз. Эффективность гормональной терапии составляет около 50% при опухолях, экспрессирующих рецепторы к эстрогенам, и 75% при опухолях, экспрессирующих рецепторы к обоим гормонам.
Если опухолевые клетки имеют низкое число рецепторов к эстрогенам, гормональная терапия обычно неэффективна. Исключение составляют случаи, когда опухолевые клетки экспрессируют рецепторы только к прогестерону. При таком варианте гормональная терапия эффективна у 10% таких больных.
Ki -67
Ki -67 это маркер пролиферативной активности. Антиген экспрессируется только во время деления клетки, в периоде ее покоя маркер отсутствует.
Показатель позволяет понять находится ли заболевание в активной фазе или ремиссии.
Показания к проведению ИГХ-исследования
- рак молочной железы;
Подготовка определяется лечащим врачом.
Диагностическое выскабливание слизистой оболочки матки рекомендовано проводить в среднюю и позднюю фазу пролиферации - на 7–10-й день менструального цикла.
Материалом для исследования являются парафиновый блок и предметные стекла. В случае если материалом является образец ткани в растворе формалина, дополнительно должна быть выполнена услуга изготовления стекол.
При проведении гистологического исследования в сторонней лаборатории необходимо предоставить протокол гистологического исследования.
Интерпретация результатов
Ответ выдается в виде описания микропретарата, применяемых красителей и заключения. Заключение может интерпретировать только врач, направивший на проведение исследования.