Анемия: причины и виды, признаки и проявления, как лечить. Местное малокровие, или ишемия Артериальное малокровие
Читайте также
Комплекс механизмов, поддерживающий кровь в жидком состоянии, без ее свертывания в просвете сосуда или просачивания через сосудистую стенку, получил название гемостаза. Так как патологические состояния, связанные со свертыванием крови разбираются в следующей лекции, то здесь следует рассмотреть другие изменения, связанные с нарушениями гемостаза.
Кровотечением (геморрагией, от греч. haima - кровь и rhein - течь) называется выход крови за пределы сосудистого русла или сердца в окружающую среду (наружное кровотечение) или в полости тела,просвет полого органа (внутреннее кровотечение). Примерами наружного кровотечения являются метроррагия (маточное), мелена (кишечное), а внутреннего - гемоперикард, гемоторакс, гемоперитонеум и гемартроз (в полость перикарда, плевры, брюшной полости или сустава соответственно).
В зависимости от источника кровотечения делятся на артериальные, венозные, артериально-венозные (смешанные), капиллярные, паренхиматозные (капиллярные из паренхиматозных органов) и сердечные.
Частным видом кровотечения является кровоизлияние, при котором кровь накапливается экстраваскулярно в тканях. Различают четыре его разновидности:
– гематома - кровоизлияние с нарушением целостности тканей и образованием полости;
– геморрагическое пропитывание (инфильтрация) - кровоизлияние с сохранением целости ткани;
– кровоподтек (синяк) - плоскостное кровоизлияние в коже, подкожной клетчатке, слизистых оболочках;
– петехии - точечные кровоизлияния в коже, слизистых и серозных оболочках, внутренних органах.
Множественные петехиальные кровоизлияния, сливающиеся между собой в более крупные по размерам, называют геморрагической пурпурой, а кровоподтек до 2 см диаметром - экхимозом.
К механизмам развития как кровотечений, так и кровоизлияний относят:
– разрыв (haemorragia per rhexin), возникающий вследствие травм неизмененного сосуда или некроза (разрыв сердца при инфаркте миокарда), воспаления (сифилитический мезаортит с разрывом аорты), аневризмы пораженной сосудистой стенки;
– разъедание (haemorragia per diabrosin), или аррозивное кровотечение, развивающееся при разрушении сосудистой стенки воспалением (чаще гнойным), злокачественной опухолью, некрозом (казеозный некроз в кровоточащей туберкулезной каверне), воздействии химических веществ (желудочный сок может вызвать кровотечение из язвы желудка), прорастании ворсинами хориона сосудов маточной трубы при внематочной беременности;
– диапедез (haemorragia per diapedesin, от греч. dia - через, pedao - скачу), отличающийся выходом крови за счет повышения сосудистой проницаемости, как правило, сохранных сосудов микроциркуляторного русла при тяжелой гипоксии, интоксикации, инфекции, различных коагулопатиях, геморрагических диатезах.
Сравнительно часто диапедезные кровоизлияния развиваются при гипертоническом кризе, системных васкулитах, лейкозах, гемофилии, уремии.
Склонность к спонтанным кровотечениям или кровоизлияниям в ответ даже на незначительное повреждение получило название геморрагического диатеза. Такое состояние связано с качественными или количественными изменениями тромбоцитов, недостаточностью гемокоагуляции, патологической ломкостью или повышенной проницаемостью сосудистой стенки как наследственными, так и приобретенными.
Основными причинами кровотечений (кровоизлияний) являются:
1. Повышенная ломкость сосудистой стенки отмечается при врожденных ее дефектах, инфекциях и интоксикациях, гипо- и авитаминозах, стероидной терапии;
2. Дефекты тромбоцитов. К ним относятся тромбоцитопении любого генеза, наследственные или приобретенные ослабления адгезии (болезни фон Виллебранда, Бернара-Сулье, наследственный геморрагический диатез и др.), ослабленная агрегация или уменьшение секреции тромбоцитов;
3. Недостаточность факторов коагуляции врожденного (гемофилия А по фактору VIII, гемофилия В по фактору IX, болезнь фон Виллебранда, по другим факторам свертывания крови) или чаще приобретенного происхождения (при заболеваниях печени, дефиците витамина К, некоторых иммунных поражениях);
4. Избыточная внутрисосудистая коагуляция, например, при диссеминированном внутрисосудистом свертывании крови - ДВС-синдроме (см. следующую лекцию).
Исход кровоизлияний может быть благоприятным (рассасывание излившейся крови, организация, инкапсуляция, образование “ржавой” кисты) и неблагоприятным (нагноение при присоединении инфекции).
Значение кровотечения обусловлено его видом, выраженностью и продолжительностью. Так, разрыв сердца при инфаркте миокарда с формированием гемоперикарда быстро приводит к смерти больного, хотя общее количество излившейся крови составляет обычно не более 100-200 г. При артериальном кровотечении может развиться массивная кровопотеря и острое малокровие с летальным исходом.
Длительное небольшое кровотечение из хронической язвы желудка или двенадцатиперстной кишки обусловливает хроническую постгеморрагическую анемию. Значение кровоизлияния зависит прежде всего от его локализации и лишь затем от его размеров. Даже небольшое кровоизлияние в головной мозг может вызвать поражение жизненно важных центров, отек мозга и смерть больного, тогда как даже массивные неосложненные кровоизлияния в подкожную клетчатку не представляют опасности для жизни.
Плазморрагия - выход из просвета сосуда плазмы крови с пропитыванием окружающих тканей (плазматическое пропитывание) вследствие повышенной сосудистой проницаемости.
Плазморрагия происходит трансэндотелиально за счет ультрафильтрации (выход плазмы через поры базальной мембраны эндотелия за счет повышения гидростатического или осмотического давления), диффузии (обусловленной градиентом плазменных компонентов в просвете и вне сосуда), микровезикулярного транспорта (микропиноцитоз или цитопемзис, происходящий вследствие активности ферментативных систем эндотелиоцитов). Возможен и интерэндотелиальный выход плазмы. Таким образом, плазморрагия определяется повреждением сосудистой стенки (прежде всего ее интимы) и изменением констант крови. При морфологическом исследовании стенка сосудов микроциркуляторного русла утолщается, становится гомогенной, а при электронно-микроскопическом исследовании в набухших эндотелиоцитах отмечается большое количество микровезикул, образование фенестр и туннелей, появление межклеточных щелей, разрыхление базальной мембраны интимы. Накопление плазменных компонентов приводит к повреждению клеток и межклеточного вещества как в сосудистой стенке, так и периваскулярных тканях, в исходе которого развивается гиалиноз, а в тяжелых случаях - фибриноидный некроз.
Артериальное малокровие бывает общим (анемия, рассматриваемая в разделе “Заболевания системы крови”) и местным (ишемия, от греч. ischo - задерживать, останавливать). Ишемия развивается при уменьшении кровенаполнения органов и тканей в результате недостаточного притока крови.
Выделяют четыре разновидности артериального малокровия в зависимости от причин и условий возникновения:
– ангиоспастическое артериальное малокровие обусловлено спазмом артерий вследствие нервного, гормонального или медикаментозного воздействия (стресс, стенокардия, аппендикулярная колика и пр.). Имеет большое значение избыточное поступление в кровь вазопрессорных агентов, таких как ангиотензин-1, вазопрессин, катехоламины и пр. Всегда острое по течению;
– обтурационное артериальное малокровие развивается из-за полного или частичного закрытия просвета артерии тромбом, эмболом (острое) или атеросклеротической бляшкой, воспалительным процессом (хроническое);
– компрессионное артериальное малокровие возникает при остром или хроническом сдавливании сосуда извне (жгут, отек, опухоль и пр.);
– артериальное малокровие в результате перераспределения крови формируется при оттоке крови в соседние, ранее ишемизированные, органы и ткани после быстрого удаления асцитической жидкости, большой сдавливающей опухоли и пр. Всегда острое. Развивающиеся в тканях изменения связаны с продолжительностью и тяжестью ишемии, а, следовательно, и гипоксии, чувствительностью органов к недостатку кислорода, наличием коллатеральных сосудов. Так, наиболее чувствительными к артериальному малокровию является головной мозг, почки, миокард, в меньшей степени - легкие и печень, тогда как соединительная, костная и хрящевая ткани отличаются значительной устойчивостью к недостатку кислорода.
Ишемия приводит к распаду в клетках креатининфосфата и АТФ, активизации процессов анаэробного окисления, приводящей к накоплению молочной и пировиноградной кислот (ацидоз), жирных кислот, усиливающей перекисное окисление липидов, повреждающее мембраны митохондрий. Усугубляющийся энергетический дефицит способствует деструкции эндоплазматической сети, накоплению в цитоплазме ионов кальция, в свою очередь активизирующих клеточные фосфолипазы, эндонуклеазы и протеазы, обусловливающие развитие некроза и апоптоза клеток. При ишемии большое значение имеет функциональное состояние органа, определяющее потребность в кислороде, величину обменных процессов. Например, при гипотермии эти показатели снижаются, что используется при операциях на сердце в условиях искусственного кровообращения.
Чем быстрее развивается ишемия, тем значительнее (вплоть до некроза) тканевые изменения пораженных тканей. При хроническом малокровии, как правило, успевает сформироваться коллатеральное кровообращение, снижающее кислородную недостаточность. Следовательно, при острой ишемии развиваются дистрофические и некротические изменения, тогда как при хронической - преобладают атрофия паренхимы и склероз стромы.
При внешнем осмотре ишемизированные участки отличаются от сохранных некоторой бледностью, иногда практически незаметной. Поэтому для макроскопического выявления ишемии применяют окраску теллуритом калия, придающего тканям, содержащим дыхательные ферменты (дегидрогенезы), сероватый или черный цвет. При этом ишемизированная область, в которой эти ферменты разрушены, становится бледно-серой или белесоватой. Микроскопически ишемия обнаруживается при выявлении гликогена или окислительно-восстановительных ферментов (например, ШИК-реакция, окраска солями тетразолия), исчезающих в пораженных участках.
В последние десятилетия отмечается учащение сегментарного некроза кишечника при полной непроходимости магистральных брыжеечных артерий. Эта патология встречается после тяжелых полостных операций у лиц любого возраста и пола, но особенно часто наблюдается у пожилых больных с хронической ишемической болезнью сердца, злокачественными новообразованиями, обширными травмами и коллаптоидными состояниями различного генеза.
Принятое название “неокклюзионный инфаркт кишечника”, диагностируемый в 20-50% случаев сосудистых поражений кишки, не отражает сути процесса, обусловленного поражением не магистральных артерий, а острой обтурационной ишемией сосудов микроциркуляторного русла вследствие микротромбов капилляров, артериол и венул. Следовательно, это патологическое состояние следует отнести к сосудистому некрозу.
Малокровием , или ишемией (от греч. ischo - задерживать), называют уменьшенное кровенаполнение ткани, органа, части тела в результате недостаточного притока крови. Речь идет как о недостаточном кровенаполнении, так и о полном обескровливании.
Общее малокровие, или анемия, является заболеванием кроветворной системы и характеризуется недостаточным содержанием эритроцитов и гемоглобина К расстройствам кровообращения анемия отношения не имеет.
Изменения ткани, возникающие при малокровии, в конечном счете связаны с гипоксией или аноксией, т. е. кислородным голоданием. В зависимости от причины, вызвавшей малокровие, момента внезапности ее возникновения, длительности гипоксии и степени чувствительности к ней ткани при малокровии возникают либо тонкие изменения на уровне ультраструктур, либо грубые деструктивные изменения, вплоть до ишемического некроза - инфаркта.
При остром малокровии обычно возникают дистрофические и некробиотические изменения. Им предшествуют гистохимические и ультраструктурные изменения - исчезновение из ткани гликогена, снижение активности окислительно-восстановительных ферментов и деструкция митохондрий. Для макроскопической диагностики применяют различные соли тетразолия, теллурит калия, которые вне участков ишемии (где активность дегидрогеназ высокая) восстанавливаются и окрашивают ткань в серый или черный цвет, а участки ишемии (где активность ферментов снижена или отсутствует) остаются неокрашенными. На основании результатов электронно-гистохимического изучения тканевых изменений при остром малокровии и при инфаркте острую ишемию следует рассматривать как преднекротическое (предынфарктное) состояние. При длительном малокровии развиваются атрофия паренхиматозных элементов и склероз в результате повышения коллагенсинтезирующей активности фибробластов.
В зависимости от причин и условий возникновения различают следующие виды малокровия: ангиоспастическое, обтурационное, компрессионное, в результате перераспределения крови.
Ангиоспастическое малокровие возникает вследствие спазма артерии в связи с действием различных раздражителей. Например, болевое раздражение может вызвать спазм артерий и малокровие определенных участков тела. Таков же механизм действия сосудосуживающих лекарственных препаратов (например, адреналина). Ангиоспастическая ишемия появляется и при отрицательных эмоциональных аффектах («ангиоспазм неотреагированных эмоций»).
Обтурационное малокровие развивается вследствие закрытия просвета артерии тромбом или эмболом, в результате разрастания соединительной ткани в просвете артерии при воспалении ее стенки (облитерирующий эндартериит), сужения просвета артерии атеросклеротической бляшкой. Обтурационная ишемия, обусловленная тромбозом артерии, нередко завершает ангиоспазм, и наоборот, ангиоспазм дополняет обтурацию артерии тромбом или эмболом.
Компрессионное малокровие появляется при сдавлении артерии опухолью, выпотом, жгутом, лигатурой.
Ишемия в результате перераспределения крови наблюдается в случаях гиперемии после анемии. Такова, например, ишемия головного мозга при извлечении жидкости из брюшной полости, куда устремляется большая масса крови.
Компрессионное малокровия различны и зависят от особенностей причины и продолжительности ее действия. Так, малокровие вследствие спазма артерий обычно непродолжительно и не вызывает особых расстройств. Однако при длительных спазмах возможно развитие дистрофических изменений и даже ишемического некроза (инфаркт). Острое обтурационное малокровие особенно опасно, так как нередко ведет к инфаркту. Если закрытие просвета артерии развивается медленно, то кровообращение может быть восстановлено с помощью коллатералей и последствия такой анемии могут быть незначительными. Однако длительно существующее малокровие рано или поздно ведет к атрофии и склерозу.
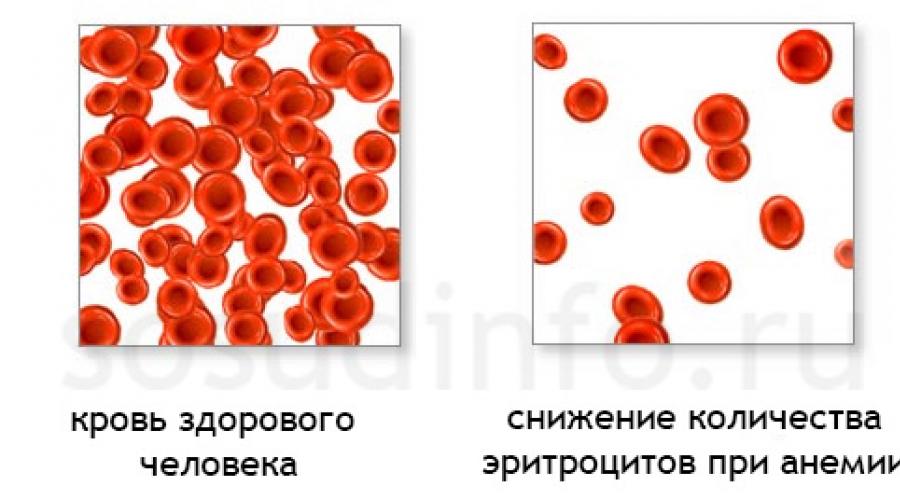
Человеческая кровь по своему составу представляет смесь плазмы (жидкой основы) и элементарных твердых частиц, представленных тромбоцитами, лейкоцитами и эритроцитами. В свою очередь тромбоциты отвечают за свертываемость, лейкоциты поддерживают в норме иммунитет, а эритроциты являются переносчиками кислорода.
Если по каким-либо причинам содержание в крови () понижается, то такая патология называется малокровием или анемией. Общие симптомы заболевания проявляются в виде бледности, слабости, головокружения и пр. В результате анемии в тканях нашего организма начинается острая нехватка кислорода.
Анемия чаще всего выявляется у женщин, нежели у мужчин. Эта патология может возникнуть на фоне каких-либо заболеваний, а также развиться как самостоятельная болезнь.
Причины и общие признаки анемий
Спровоцировать анемию может довольно много факторов. Одними из наиболее частых причин анемии по праву считаются нехватка фолиевой кислоты, или витамина В12. Также анемия развивается из-за обильных кровотечений во время менструации или на фоне некоторых онкологических болезней. Часто малокровие проявляется из-за недостаточности веществ, которые отвечают за выработку гемоглобина, а также сбои в процессе образования эритроцитов. Передающиеся по наследству заболевания и воздействие ядовитых веществ тоже могут стать причиной развития малокровия.

Чаще всего у страдающих анемией отмечаются следующие симптомы:
- Желтоватая, шелушащаяся, холодная на ощупь и бледная кожа.
- Слабость, быстрая утомляемость, сонливость и головокружения, в тяжелых случаях сопровождающиеся обмороками.
- Пониженное артериальное давление.
- Желтоватый оттенок глазных белков.
- Отдышка.
- Ослабленный мышечный тонус.
- Учащенное биение сердца.
- Увеличение размеров селезенки.
- Измененный цвет стула.
- Липкий, холодный пот.
- Рвота, тошнота.
- Покалывания в ногах и руках.
- Начинают выпадать волосы и ломаться ногти.
- Частые головные боли.

Видео: что такое анемия и какие части тела от нее страдают?
Классификация
В целом классификация анемии основывается на трех группах:
- Постгеморрагические анемии, т.е. малокровие, вызванное сильной .
- Анемия, образовавшаяся на фоне нарушений в процессе образования крови, а также патологий в синтезе РНК и ДНК – мегалобластная, железодефицитная, фолиеводефицитная, В-12-дефицитная, гипопластическая, апластическая, анемия Фанкони и пр. виды.
- Гемолитические анемии, т.е. малокровие, возникающее по причине повышенного эритроцитного разрушения (аутоимунная гемолитическая анемия, серповидноклеточная анемия и пр.).
Кроме этого, анемия подразделяется и на несколько степеней тяжести, которые зависят от содержания гемоглобина. Это:
- Тяжелая степень – когда гемоглобина в составе крови меньше, чем 70 гл.
- Средняя – 70-90 г/л.
- Легкая – более 90 г/л (анемия 1 степени).
Постгеморрагические анемии
Данные виды анемий могут быть хронической или острой формы. Хронические как правило, является последствием неоднократных потерь крови, например, при ранениях и травмах, обильных менструациях, язве желудка, или раковых заболеваниях и пр. Острая форма постгеморрагической анемии развивается из-за однократной, но значительной кровопотери.
При этом клиника острого постгеморрагического малокровия представлена значительным ухудшением общего состояния пациента, связанным с : учащенным сердцебиением, мельканием «мошек», слабостью, одышкой, шумом в ушах, головокружением и т.д. Цвет кожи становится значительно бледнее, иногда с желтоватым оттенком. Общая температура тела больного снижена, глазные зрачки расширенные.
Интересен тот факт, что анализ крови, проведенный в течение 2-3 часов после кровопотери (при острой форме постгеморрагического малокровия) показывает нормальное содержание эритроцитов и гемоглобина. Их показатели начинают снижаться позднее. Стоит отметить, что кровь при этом сворачивается значительно быстрее.
Самым действенным способом лечения анемии постгеморрагической формы считается . После чего врач, как правило, назначает больному прием антианемических средств, обогащенное белками питание.
Если же форма хроническая, то, как правило, особых изменений в состоянии пациент не замечает. Обычно наблюдается некоторая бледность, головокружение при резком вставании и слабость. В начальных стадиях нормальный состав крови обеспечивается костным мозгом. Со временем он с этой функцией уже не справляется и развивается гипохромная анемия. Это малокровие, при котором находится на низком уровне , что говорит о низком содержании гемоглобина в эритроцитах. У пациента при этом начинают ломаться ногти и выпадать волосы.

При хронической форме постгеморрагического малокровия железу становится затруднительно усваиваться в организме, что приводит к существенным нарушениям, связанным с образованием гемоглобина. Максимальная эффективность лечения достигается путем нейтрализации источника потери крови.
В дополнение назначается прием железосодержащих препаратов. Наиболее популярные и действенные в этом случае лекарства от анемии: ферроплекс, феррум лек, конферон, феррокаль, феромид и пр. Лечение железосодержащими препаратами протекает довольно долгое время. Врачи советуют пересмотреть рацион – он должен основываться на продуктах, обогащенных животным белком (мясо, печень) и содержащих много железа (гречка, яблоки, гранат).
Анемии, развивающиеся на фоне нарушений образования крови
Железодефицитные анемии
Как правило, железодефицитная анемия (ЖДА) развивается из-за нехватки в организме такого элемента как железо. Этому могут способствовать различные нарушения, связанные с усвоением железа, либо же употребляемая пища бедна на этот элемент (например, у сидящих на жесткой и длительной диете). Также ЖДА часто встречается у доноров и людей, страдающих гормональными нарушениями.
Помимо перечисленного выше, ЖДА может возникнуть из-за длительных и обильных менструальных или раковых кровотечений. Довольно часто эта анемия диагностируется у беременных, поскольку их потребности в этом элементе на время беременности значительно возрастают. И вообще, ЖДА чаще всего встречаются у детей и женщин.

Симптомов железодефицитной анемии довольно много и они часто схожи с симптоматикой других анемий:
- Во-первых, кожа. Она становится тусклой, бледной, шелушащейся и сухой (обычно на руках и лице).
- Во-вторых, ногти. Они становятся ломкими, тусклыми, мягкими и начинают расслаиваться.
- В-третьих, волосы. У людей с ЖДА они становятся ломкими, секутся, начинают интенсивно выпадать и медленно расти.
- В-четвертых, зубы. Одним из характерных признаков железодефицитной анемии является раскрашивание зубов и кариес. Эмаль на зубах становится шероховатой, а сами зубы теряют былой блеск.
- Часто признаком анемии выступает заболевание, например, атрофический гастрит, функциональные нарушения кишечника, мочеполовой сферы и пр.
- Больные ЖДА страдают вкусовым и обонятельным извращением. Это проявляется в желании съесть глину, мел, песок. Часто таким пациентам неожиданно начинает нравиться запах лака, краски, ацетона, бензина, выхлопных газов и пр.
- Железодефицитная анемия отражается и на общем состоянии. Ее сопровождают частые боли в области головы, учащенное сердцебиение, слабость, мелькание «мошек», головокружение, сонливость.
Анализ крови при ЖДА показывает серьезное падение гемоглобина. Уровень эритроцитов снижен также, но в меньшей степени, так как анемия носит гипохромный характер (цветовой показатель имеет тенденцию к снижению). В кровяной же сыворотке содержание железа значительно падает. Из периферической крови полностью исчезают сидероциты.
Лекарства при железодефицитной анемии
Лечение основывается на приеме железосодержащих лекарств как таблетированных, так и в виде инъекций. Чаще всего врач выписывает препараты железа из списка, представленного ниже:
- Феррум-лек;
- Феррокаль;
- Ферковен;
- Феррамид;
- Ферроплекс;
- Фербитол;
- Гемостимулин;
- Имферон;
- Конферон и пр.
Диета при анемии

Помимо лекарственных препаратов врачи советуют придерживаться определенной диеты, связанной с ограничением мучных, молочных и жирных продуктов. Полезны такие продукты как гречка, картофель, чеснок, зелень, печень, мясо, шиповник, смородина и пр.
Чаще всего развивается данная анемия при беременности. Больным с ЖДА полезен как лесной, так и горный воздух, физкультура. Желательно употреблять минеральную воду из железноводских, марциальных и ужгородских источников. Не стоит забывать и о профилактике в осенне-весенние периоды, когда организм особенно ослаблен. В эти периоды будет полезна диета при анемии, богатая железосодержащими продуктами питания (см. выше и на рисунке справа).
Видео: железодефицитная анемия – причины и лечение
Апластические и гипопластические анемии
Эти анемии представляют собой комплекс патологий, характеризующихся функциональной недостаточностью костного мозга. Апластическое малокровие отличается от гипопластического более угнетенным кроветворением.
Чаще всего возникновению гипопластической анемии способствует радиация, определенные инфекции, негативное влияние химических или лекарственных препаратов, либо наследственность. Все возможные формы гипо- и апластических анемий имеют постепенный характер развития.
Проявляются эти анемии повышением температуры, ангиной, сепсисом, лишним весом, бледностью, и десенными , мелкоточечными капиллярными кровоизлияниями на слизистых и коже, жжением во рту. Часто заболевание сопровождается осложнениями инфекционной природы, например, абсцесс после укола, пневмония и пр.). Часто страдает и печень – она, как правило, становится больше.
Железообмен в организме нарушается, при этом количество железа в крови повышенное. Лейкоцитов в составе крови становится гораздо меньше, как и гемоглобина, а вот молодые формы эритроцитов вовсе отсутствуют. В каловых массах и моче часто присутствуют кровянистые примеси.

В тяжелой степени апластическая анемия (как и гипопластическая) чревата летальным исходом. Лечение даст хорошие результаты только в случае своевременности. Оно проводится только в стационаре и подразумевает повышенный гигиенический уход за ротовой полостью и кожными покровами. При этом осуществляется неоднократное переливание крови, антибиотикотерапия, прием витаминов и гормонов, а также желательно полноценное питание при анемии. Иногда врачи прибегают к пересадке (переливанию) костного мозга (это возможно при наличии донора, совместимого по HLA-системе, которая предусматривает специальный подбор).
Анемия Фанкони
Это довольно редко встречающаяся разновидность врожденных анемий, связанная с хромосомными аномалиями, дефектами в стволовых клетках. Встречается предпочтительно у мальчиков. У новорожденных эта патология, как правило, не наблюдается. Для нее характерны симптоматические проявления в 4-10-летнем возрасте в виде кровотечений и кровоизлияний.
В костном мозге наблюдается увеличение жировых тканей, при этом клеточность понижена, а кроветворение имеет угнетенный характер. Исследования показывают, что у детей с анемией Фанкони эритроциты живут ≈ в 3 раза меньше нормы.
Для внешности больного с этой анемией характерна ненормальная пигментация, маленький рост, недоразвитость черепа или скелета, косолапость. Нередко эти симптомы дополняются умственной отсталостью, косоглазием, глухотой, недоразвитостью половых органов, почек, .
Анализы крови показывают изменения, схожие с апластической анемией, только выражены они гораздо меньше. Анализ мочи у большинства пациентов показывает на высокое содержание в ней аминокислот.

Анемия Фанкони – частный случай апластической анемии с нарушением образования эритроцитов в костном мозге
Больные анемией Фанкони, согласно исследованиям, имеют высокую предрасположенность к острому лейкозу.
По своей сути, анемия Фанкони является тяжелой формой апластической анемии, описанной выше. Лечение заключается в удалении селезенки, с применением после этого антилимфоцитарного глобулина. Также применяются иммунодепрессанты, андрогены. Но самым эффективным лечением зарекомендовала себя пересадка костного мозга (доноры – сестра или брат больного или чужие люди, совпадающие по HLA-фенотипу).
Данная патология еще недостаточно изучена. Хотя, несмотря на врожденную природу, эта анемия у грудничков не проявляется. Если же заболевание диагностировано поздно, то такие больные не проживают больше 5 лет. Смерть наступает по причине кровоизлияний в желудок или мозг.
Мегалобластные анемии
Эти анемии являются как наследственными, так и приобретенными. Для них характерно наличие мегалобластов в костном мозге. Это такие ядросодержащие клетки, которые являются предшественниками эритроцитов и содержат неконденсированный хроматин (в такой клетке молодое ядро, но окружающая его цитоплазма уже старая).
И В-12-дефицитная, и фолиеводефицитная анемии относятся к подвидам мегалобластной анемии. Иногда даже диагностируется смешанная В-12-фолиеводефицитная анемия, но встречается она довольно редко.
В-12-дефицитная анемия
В-12-дефицитное малокровие развивается из-за нехватки витамина В-12. Этот микроэлемент необходим для правильного функционирования нервной системы, а также он нужен костному мозгу для образования и роста в нем эритроцитов. В-12 участвует непосредственно в синтезе РНК и ДНК, потому-то и нарушается процесс образования развития эритроцитов при его нехватке.
Для отличительным признаком является некоторая шаткость в походке, . Также болезнь сопровождается сердечными болями, отеками конечностей, слабостью, пониженной работоспособностью, бледной желтушностью и одуловатостью лица, шумом в ушах, жжением и зудом на языке.
Обычно нехватка В-12 наступает из-за нарушений его всасывания. Этому больше подвержены люди, имеющие атрофию желудочных слизистых, хронический энтерит, глютеновую болезнь. Дефицит В-12 может стать последствием панкреатита. Часто он встречается у вегетарианцев, а также людей пожилого возраста.
Такое малокровие еще называют пернициозной анемией. Развивается заболевание очень медленно, переходя, как правило, в хроническую рецидивирующую форму.
Лечение осуществляется с помощью парентерального применения витамина В-12 (делают ежедневные внутримышечные инъекции). Также показан рацион, обогащенный В-12-содержащими продуктами: печень, яйца, молочные продукты, мясо, сыр, почки.
Фолиеводефицитная анемия
Фолиеводефицитное малокровие представляет собой острую нехватку в организме фолиевой кислоты. Она тоже (как и В-12) активно участвует в образовании эритроцитов. Фолиевая кислота доставляется в наш организм через продукты питания (мясо, шпинат и пр.), но при термической обработке этих продуктов она теряет свою активность.

Такая анемия зачастую проявляется у детей, вскормленных козьим или порошковым молоком, и у беременных женщин. При этом болезнь сопровождается головокружением и слабостью, одышкой и утомляемостью. Кожа становится суховатой и приобретает бледный желтовато-лимонный оттенок. Больного может часто знобить и лихорадить.
Изменения в крови идентичны В-12-дефицитной анемии. Как правило, гемоглобин остается в норме, а иногда даже повышен. В составе крови присутствуют макроциты – это эритроциты, имеющие увеличенный размер. Для фолиеводефицитной анемии вообще характерно пониженное количество всех кровяных клеток при увеличении их размера. Это гиперхромная анемия с довольно высоким показателем цвета. Биохимия крови показывает, что немного повышен.
Фолиеводефицитное малокровие лечат с помощью лекарственных препаратов фолиевой кислоты в таблетированной форме. Помимо этого следует подкорректировать и питание пациента (предпочтительны листовые овощи, печень, больше фруктов).
Отдельно следует отметить, что В-12- и фолиеводефицитная анемия являются разновидностями макроцитарной анемии – это патология, характеризующаяся увеличением размеров эритроцитов из-за острой нехватки В-12 или фолиевой кислоты.
Гемолитические анемии
Все разновидности этих анемий обусловлены чрезмерным разрушением эритроцитов. В норме продолжительность жизни эритроцитов составляет ≈120 суток. Когда же у человека появляются антитела против его же эритроцитов, то начинается резкое эритроцитарное разрушение, т.е. жизнь эритроцитов становится значительно короче (≈13суток). Гемоглобин в крови начинает распадаться, из-за чего у больного развивается желтуха на фоне гемолитической анемии.
Лабораторным симптомом такой анемии является повышенный билирубин, присутствие в моче гемоглобина и пр.
Значительное место среди таких анемий занимают наследственные разновидности. Они являются последствиями множества дефектов в образовании эритроцитов на генетическом уровне. Приобретенные разновидности гемолитических анемий развиваются на фоне определенных факторов, оказывающих на эритроциты разрушающее действие (воздействие механического характера, различные яды, антитела и т. д.).
Cерповидно-клеточная анемия
Одной из распространенных наследственных гемолитических анемий является серповидно-клеточная. Это заболевание подразумевает присутствие патологического гемоглобина в эритроцитах. Эта патология чаще поражает афроамериканцев, но встречается и у светлокожих людей.
Наличие в крови серповидных эритроцитов, характерное для этой патологии, ее носителю обычно ничем не грозит. Но если и мать, и отец имеют в крови этот патологический гемоглобин, то их дети рискуют родиться с тяжелейшей формой серповидно-клеточного малокровия, именно поэтому такая анемия опасна.

фото: кровь при гемолитической анемии. Эритроциты – неправильной формы
Сопровождается эта разновидность анемии ревматическими болями, слабостью, болями в животе и голове, сонливостью, припухлости голеней, кистей и стоп. Врачебный осмотр обнаруживает бледность слизистых и кожи, увеличенную селезенку и печень. Для имеющих эту патологию людей характерно худое телосложение, высокий рост и искривленный позвоночник.
Анализ крови показывает умеренную, либо тяжелую степень анемии, причем показатель цвета будет в норме.
Данная патология – тяжелейшее заболевание. Основная масса пациентов умирает, как правило, не дожив до десятилетнего возраста, по причине какой-либо инфекции (чаще туберкулеза) или внутреннего кровоизлияния.
Лечение этого малокровия является симптоматическим. Хоть оно и считается хронической анемией, дети довольно легко переносят низкое содержание эритроцитов и гемоглобина. Именно поэтому им довольно-таки редко проводят переливание крови (чаще в случаях апластического или гемолитического криза). Следует избегать всевозможных инфекций, особенно детям.
Аутоимунная гемолитическая анемия
Среди приобретенных разновидностей чаще встречается аутоимунная гемолитическая анемия. Она подразумевает воздействие образовавшихся в организме больного антител. Такая разновидность встречается, как правило, при хронических циррозах и гепатитах, ревматоидных артритах, остром лейкозе, либо хроническом лимфолейкозе.
Бывает хроническая, а также острая форма аутоимунной гемолитической анемии. Хроническая форма протекает практически без характерных симптомов. При острой форме больной страдает желтухой, одышкой, слабостью, лихорадкой, частым сердцебиением. Каловые массы по причине чрезмерного содержания стеркобилина имеют темно-коричневый оттенок.
Хотя и редко, но можно встретить аутоиммунную анемию с полными холодовыми антителами, которая свойственна людям преклонного возраста. Холод в подобных случаях выступает в качестве6 провоцирующего фактора, приводящего к отеку и посинению пальцев рук, лица, стоп. Часто аутоиммунная анемия такого типа сопровождается синдромом Рейно, который, к сожалению, может закончиться гангреной пальцев. Кроме этого, у больных с холодовой аутоиммунной анемией невозможно определить традиционными методами.
Лечение осуществляется с помощью глюкокортикоидных гормонов. Важную роль в лечении играет его длительность и правильная дозировка препаратов. Также в лечении врачи используют цитостатические препараты, проводят плазмаферез, а при необходимости – спленэктомию.
Видео: анемия в программе “Жить здорово!”
Следует помнить, что многие разновидности анемий при неправильном их лечении могут иметь тяжелейшие последствия для организма, вплоть до летального исхода. Поэтому не надо заниматься самолечением. Диагноз должен поставить квалифицированный врач, равно как и назначить эффективное и правильное лечение!
Транспортно-обменную функцию, направленную на поддержание гомеостаза, в различных органах и тканях выполняют системы крово- и лимфообращения, тесно связанные между собой. Их состояние во многом зависит от показателей осмотического и онкотического давления, водно-электролитного баланса, уровня гормонов
(прежде всего ренин-ангиотензин-альдостероновой системы), влияющих на сосудистое русло. Поэтому любое их нарушение влечет за собой изменения метаболизма и различные повреждения клеток и тканей. Так, например, возрастание гидростатического давления, снижение онкотического давления плазмы, нарушение лимфооттока
при целом ряде патологических состояний, особенно сопровождающихся задержкой натрия и воды, приводят к формированию отека Среди расстройств кровообращения выделяют нарушения кровенаполнения и гемостаза.
Нарушения кровенаполнения заключаются в артериальном или венозном полнокровии (гиперемии) и отражают патологическое увеличение объема циркулирующей крови в пораженной системе органов, органе, ткани. Кроме того, выделяют артериальное малокровие, рассматриваемое в следующей лекции.
Артериальная гиперемия - увеличение кровенаполнения органов и тканей в результате увеличения притока артериальной крови.
Выделяют следующие ее виды:
общая - возникает при увеличении объема циркулирующей крови (плетора) или количества эритроцитов (эритремия);
местная - может быть физиологической (рабочей, от воздействия физических факторов, например, при жаркой погоде, а также рефлекторной) и патологической:
– воспалительная - один из признаков воспаления;
– постишемическая - формируется после устранения фактора, вызвавшего сдавление артерии (снятие жгута, удаление асцита или большой полостной опухоли), что приводит к малокровию (ишемии) соседних органов;
– дискомпрессионная, или вакатная (от лат. vacuus - пустой) - обусловлена падением барометрического давления, например, при постановке медицинских банок; быстром удалении жидкости при асците или гидротораксе; при кессонной болезни, возникшей в результате быстрого подъема с глубины, после разгерметизации самолетов, барокамер, сочетается с кровоизлияниями и газовой эмболией в пораженных тканях.
Кроме того, выделяют и другие, сравнительно редко встречающиеся виды артериальной гиперемии:
- ангионевротическую (возникающую при нарушении иннервации),
- коллатеральную (развивающуюся при затруднении оттока крови по магистральному сосуду), при артериовенозном шунте (образующемся при ранениях, а также при незаращенном боталловом протоке, овальном окне в сердце, когда артериальная кровь поступает в вены).
Гиперемированные ткани приобретают красноватый оттенок, их температура повышается. Артериальная гиперемия самостоятельного значения в патологии не имеет, хотя наблюдаются отдельные случаи развития миелоцитарного лейкоза у больных с эритремией.
Венозное полнокровие (венозный застой) - увеличение кровенаполнения органов и тканей в результате уменьшения оттока крови при неизмененном или незначительно уменьшенном ее притоке. Может быть
острым и хроническим, общим и местным.
Общее венозное полнокровие - часто встречающееся патологическое состояние, развивающееся при патологии сердца и отражающее острую или хроническую сердечно-сосудистую недостаточность, возникающую, например, при инфаркте миокарда, остром миокардите или хронической ишемической болезни сердца, пороках и опухолях сердца, кардиомиопатиях. Хроническая сердечно-сосудистая недостаточность наиболее часто встречается в пожилом возрасте, достигая 10% по распространенности у лиц старше 75 лет.
Снижение сердечного выброса в результате поражения желудочка ведет к увеличению его диастолического объема, повышению давления и объема крови в соответствующем предсердии и расположенной выше венозной системе. В случаях левожелудочковой сердечной недостаточности венозный застой отмечается в малом круге кровообращения (в легких), тогда как при правожелудочковой недостаточности поражаются органы и ткани большого круга кровообращения.
Однако, как правило, сравнительно быстро (в течение нескольких недель, месяцев, а тем более при хронических заболеваниях сердца) изменения генерализованно захватывают всю венозную систему.
Независимо от вызвавшей ее причины сердечно-сосудистая недостаточность (схема 4.2) сопровождается задержкой почками натрия и воды (прежде всего из-за активации альдостерона), что ведет согласно закону Старлинга к компенсаторному усилению сократимости миокарда вследствие увеличения нагрузки и его растяжения. Происходит активация нервных и эндокринных регуляторных механизмов, направленных на увеличение минутного сердечного выброса крови. Это прежде всего рефлекторная тахикардия, стимулируемая
катехоламинами, поддержание сосудистого тонуса (артериального давления) под воздействием ангиотензина и вазопрессина. Кроме того, спазм артериол препятствует на первых порах распространению венозного застоя на микроциркуляторное русло (капилляры и венулы).
Однако в последующем задержка ионов натрия и воды способствует увеличению объема циркулирующей крови и еще большему венозному застою в легких, отекам, тканевой гипоксии. Активация нервных и эндокринных факторов повышает также потребление тканями кислорода, увеличивает общее периферическое сосудистое сопротивление. Нарастает уровень эндотелинов, предсердного натрийуретического пептида, брадикининов и простагландинов, усугубляющих состояние сердечно-сосудистой системы. Соответствующие отделы сердца
при этом подвергаются повышенной нагрузке, рабочей гипертрофии , компенсирующей на первых порах возникающие гемодинамические сдвиги. В последующем происходит истощение адаптивных возможностей миокарда, полости сердца расширяются, развивается эксцентрическая гипертрофия сердца , отражающая формирующуюся декомпенсацию органа.
Острое общее венозное полнокровие. Вследствие недостатка кислорода в венозной крови в тканях развиваются гипоксия и ацидоз, повышается сосудистая проницаемость, прежде всего в микроциркуляторном русле, что приводит к плазматическому пропитыванию и отеку, дистрофическим, а в тяжелых случаях
и некротическим изменениям, к множественным диапедезным кровоизлияниям. Следует отметить, что прежде всего поражаются органы, депонирующие кровь - легкие, печень, кожа с подкожной клетчаткой, почки, селезенка, но вследствие структурно-функциональных особенностей развивающиеся в них изменения отличаются друг от друга.
В легких развиваются отек (кардиогенный отек ) и точечные кровоизлияния преимущественно в субплевральных (наиболее удаленных от магистрального кровотока) отделах, что способствует прогрессированию гемодинамических нарушений и легочной недостаточности.
В почках вследствие ишемии происходит сброс крови по юкстамедуллярному шунту, приводящий к малокровию коры и полнокровию мозгового вещества, дистрофии и в тяжелых случаях некрозу эпителия проксимальных и дистальных канальцев. В последнем случае развивается острая почечная недостаточность (некротический нефроз ).
В печени отмечается полнокровие, значительное расширение венозных сосудов центральных отделов долек с возможными кровоизлияниями и некрозом центролобулярных гепатоцитов.
Селезенка за счет заполнения кровью синусов увеличена, с гладкой капсулой, с поверхности разреза обильно стекает кровь.
Хроническое общее венозное полнокровие характеризуется теми же процессами, что и острое, а также атрофией паренхимы и склерозом стромы (схема 4.4) за счет активации фибробластов и разрастания соединительной ткани, приводящей к уплотнению (индурации ) пораженных органов и тканей. Хронический отек
и плазморрагия вызывают также вторичную перегрузку лимфатической системы и ее недостаточность, что усугубляет тканевые изменения, развивающиеся по принципу “порочных кругов”. Формируется капиллярно-паренхиматозный блок (капилляро-трофическая недостаточность), характеризующийся следующими морфологическими критериями:
1. Редукция капилляров, обусловленная хронической ишемией . Развивается склероз микрососудов, сужение их просвета вплоть до полной облитерации, атрофия эндотелиоцитов. Изменения могут захватывать как участок органа или ткани, так и целый орган или носить системный характер. Формируется централизация микрогемодинамики за счет тока крови по магистральным сосудам микроциркуляторного русла. Это приводит к уменьшению объема транскапиллярного кровотока, увеличивает тканевую гипоксию, нарушает обмен веществ в сосудистой стенке и окружающих тканях, усугубляет недостаточность лимфатической системы, что обусловливает нарастающую дистрофию, атрофию паренхиматозных клеток и склероз стромы органов и тканей.
2. Преобразование истинных капилляров в емкостные (депонирующие) вследствие хронического венозного застоя. Полнокровные истинные капилляры удлиняются, становятся извитыми, просвет их расширяется, так что эритроциты располагаются в них не в один, а в два ряда. Одновременно происходит очаговая пролиферация
капилляров, в связи с чем их плотность в пораженных тканях возрастает. Также дилатируют посткапилляры и венулы, трансформирующиеся в мелкие вены. В результате количество истинных капилляров в ткани уменьшается, значительное количество артериальной крови поступает по магистральным микрососудам сра-
зу в венозную систему, что еще больше увеличивает гипоксические и метаболические изменения в тканях, чему способствует формирующаяся хроническая недостаточность лимфатических капилляров.
3. Скорости развития и выраженности описанных изменений способствуют первичный дефицит истинных капилляров, наблюдаемый у недоношенных детей, а также генетические особенности того или иного
больного. Этот критерий отражает незрелость микроциркуляторного русла и обменного звена микрогемодинамики. Так, при недоношенности отмечается централизация микроциркуляции с понижением капиллярного кровотока и транскапиллярного обмена. Значительно большее значение и распространение имеет программируемая редукция истинных капилляров, носящая системный характер и наблюдаемая при старении. У пожилых лиц, как и в условиях патологии, поражение микрососудов, начинаясь с дистально расположенных капилляров, захватывает пре-, посткапилляры, а также магистральные капилляры, артериоло-артериолярные, венуло-венулярные и артериоло-венулярные анастомозы с формированием еще большей централизации микрогемодинамики и нарастающей трофической и кислородной недостаточности тканей.
Следует отметить, что централизация микроциркуляторного кровообращения первоначально имеет компенсаторное значение, так как способствует разгрузке периферических капилляров. Однако со временем длительная тканевая гипоксия вызывает необратимые некротические, атрофические и склеротические изменения. Наличие депонирующих капилляров, артериоло-венулярных и других коллекторов ведет к значительной перегрузке венозного русла, дилатации просвета микрососудов, их атонии и, в конечном счете, к еще большей венозной гиперемии. Получается замкнутый порочный круг, разорвать который возможно лишь на начальных стадиях его формирования.
Вследствие названных причин при хроническом общем венозном полнокровии развиваются следующие изменения:
в коже и подкожной клетчатке, особенно нижних конечностей, наблюдаются расширение и полнокровие венозных сосудов (цианоз), отек вплоть до анасарки , атрофия эпидермиса, склероз собственно дермы, застой лимфы. В дистальных отделах конечностей и в ногтевых ложах из-за развитой венозной сети отмечается
акроцианоз . На фоне хронического венозного застоя часто развиваются длительно не заживающие и трудно поддающиеся лечению трофические язвы стоп и голеней ;
в серозных полостях из-за скопления отечной жидкости (транссудата) развивается гидроторакс, гидроперикард и асцит. По сравнению с другими видами транссудата асцитическая жидкость богата
белками, прежде всего альбумином, а также содержит глюкозу, натрий и калий;
в печени отмечается развитие мускатной печени , напоминающей по своему виду срез мускатного ореха. Орган увеличен в размерах, плотноватой консистенции, с закругленными краями. Венозная гиперемия и кровоизлияния в центральных отделах долек, атрофия и некроз центролобулярных гепатоцитов, а также жировая дистрофия печеночных клеток на периферии долек придают печени на разрезе пестрый вид за счет чередования темно-красных и желтовато-коричневых участков. Дальнейшему распространению венозной крови из центральной части препятствует более высокое давление в системе печеночной артерии на периферии дольки.
Хроническая гипоксия приводит к разрастанию соединительной ткани по ходу синусоидов (капилляризации синусоидов ), являющейся отражением развития капиллярно-паренхиматозного блока, увеличивающего кислородную недостаточность и метаболические нарушения. В финале формируется мускатный фиброз , а затем
и мускатный (кардиальный) мелкоузловой цирроз печени ;
в легких вследствие диапедеза эритроцитов из гиперемированных венозных сосудов развивается гемосидероз , а также диффузное разрастание соединительной ткани в межальвеолярных перегородках, вокруг бронхов и сосудов, что придает органам буроватую окраску и плотную консистенцию - бурая индурация легких . В мокроте больного при микроскопическом исследовании обнаруживают гемосидерофаги, получившие название клеток сердечной недостаточности , или сердечных пороков. Выраженные склеротические процессы обусловлены не только хронической гипоксией, но и резорбционной, а затем и механической (из-за “забивания” просвета лимфатических капилляров сидерофагами) недостаточностью лимфатической системы, а также склерогенным эффектом SH-ферритина, входящего в состав гемосидерина, обладающего к тому же вазопаралитическим действием, еще больше увеличивающим венозный застой;
в почках развивается цианотическая индурация , обусловленная венозным застоем и лимфостазом, особенно выраженными вследствие сброса крови в мозговое вещество по юкста-медуллярному шунту. Органы увеличены в размерах, плотные, синюшные. Снижение ударного объема сердечного выброса при хронической сердечно-сосудистой недостаточности приводит к уменьшению почечного кровотока, что наряду с капиллярно-паренхиматозным блоком увеличивает тканевую гипоксию, стимулирует ренинангиотензиновую систему (спазм внутрипочечных артериальных сосудов) и еще больше нарушает метаболические процессы (дистрофия эпителия канальцев), и активирует склероз стромы органов;
в селезенке отмечается увеличение размеров (застойная спленомегалия ), уплотнение, синюшная окраска, отсутствие соскоба пульпы, что получило название цианотическая индурация селезенки .
При гистологическом исследовании фолликулы атрофичны, красная пульпа склерозирована, полнокровна. Особенно выражены эти изменения при портальной гипертензии, вызванной мускатным фиброзом или кардиальным циррозом печени.
Местное венозное полнокровие. В пораженных органах и тканях отмечаются в зависимости от родолжительности процесса острые или хронические изменения, аналогичные общему венозному полнокровию. По этиологии выделяют 3 его разновидности:
обтурационное , обусловленное закрытием просвета вены тромбом, эмболом, воспалительным процессом. Может быть как острым, так и хроническим;
компрессионное , возникающее при остром или хроническом сдавлении вены извне жгутом, опухолью, разрастающейся рубцовой тканью;
коллатеральное , формирующееся при затруднении оттока крови по магистральному венозному сосуду.
Например, при портальной гипертензии вследствие цирроза печени происходит сброс крови по порто-кавальным анастомозам с развитием венозной гиперемии и варикозного расширения вен пищевода, кардиального отдела желудка, геморроидального сплетения, вен передней брюшной стенки (“голова медузы”). При этом отмечается также развитие асцита и застойной спленомегалии, характеризующейся значительным увеличением массы селезенки (до 700 г и более), расширением синусоидов, заполненных кровью, гемосидерозом и склерозом пульпы. Портальная гипертензия возникает при любом диффузном склеротическом процессе в печени, приводящем к сдавлению ее микроциркуляторного русла. В результате прохождение крови из воротной вены в печеночную затрудняется, формируется венозный застой печени.
Значение местного венозного полнокровия заключается также в возможности развития красных (венозных) инфарктов, например, в селезенке при тромбозе или остром сдавлении селезеночной вены.
Нарушения гемостаза. Комплекс механизмов, поддерживающий кровь в жидком состоянии, без ее свертывания в просвете сосуда или просачивания через сосудистую стенку, получил название гемостаза. Так как патологические состояния, связанные со свертыванием крови разбираются в следующей лекции, то здесь
следует рассмотреть другие изменения, связанные с нарушениями гемостаза.
Кровотечением (геморрагией, от греч. haima - кровь и rhein - течь) называется выход крови за пределы сосудистого русла или сердца в окружающую среду (наружное кровотечение) или в полости тела,просвет полого органа (внутреннее кровотечение). Примерами наружного кровотечения являются метроррагия (маточное), мелена (кишечное), а внутреннего - гемоперикард, гемоторакс, гемоперитонеум и гемартроз (в полость перикарда, плевры, брюшной полости или сустава соответственно).
В зависимости от источника кровотечения делятся на артериальные, венозные, артериально-венозные (смешанные), капиллярные, паренхиматозные (капиллярные из паренхиматозных органов) и сердечные.
Частным видом кровотечения является кровоизлияние, при котором кровь накапливается экстраваскулярно в тканях. Различают четыре его разновидности:
гематома - кровоизлияние с нарушением целостности тканей и образованием полости;
геморрагическое пропитывание (инфильтрация) - кровоизлияние с сохранением целости ткани;
кровоподтек (синяк) - плоскостное кровоизлияние в коже, подкожной клетчатке, слизистых оболочках;
петехии - точечные кровоизлияния в коже, слизистых и серозных оболочках, внутренних органах.
Множественные петехиальные кровоизлияния, сливающиеся между собой в более крупные по размерам, называют геморрагической пурпурой, а кровоподтек до 2 см диаметром - экхимозом.
К механизмам развития как кровотечений, так и кровоизлияний относят:
разрыв (haemorragia per rhexin), возникающий вследствие травм неизмененного сосуда или некроза (разрыв сердца при инфаркте миокарда), воспаления (сифилитический мезаортит с разрывом аорты), аневризмы пораженной сосудистой стенки;
разъедание (haemorragia per diabrosin), или аррозивное кровотечение, развивающееся при разрушении сосудистой стенки воспалением (чаще гнойным), злокачественной опухолью, некрозом (казеозный некроз в кровоточащей туберкулезной каверне), воздействии химических веществ (желудочный сок может вызвать
кровотечение из язвы желудка), прорастании ворсинами хориона сосудов маточной трубы при внематочной беременности;
диапедез (haemorragia per diapedesin, от греч. dia - через, pedao - скачу), отличающийся выходом крови за счет повышения сосудистой проницаемости, как правило, сохранных сосудов микроциркуляторного русла при тяжелой гипоксии, интоксикации, инфекции, различных коагулопатиях, геморрагических диатезах.
Сравнительно часто диапедезные кровоизлияния развиваются при гипертоническом кризе, системных васкулитах, лейкозах, гемофилии, уремии.
Склонность к спонтанным кровотечениям или кровоизлияниям в ответ даже на незначительное повреждение получило название геморрагического диатеза. Такое состояние связано с качественными или количественными изменениями тромбоцитов, недостаточностью гемокоагуляции, патологической ломкостью или повышенной проницаемостью сосудистой стенки как наследственными, так и приобретенными.
Основными причинами кровотечений (кровоизлияний) являются:
1. Повышенная ломкость сосудистой стенки отмечается при врожденных ее дефектах, инфекциях и интоксикациях, гипо- и авитаминозах, стероидной терапии;
2. Дефекты тромбоцитов. К ним относятся тромбоцитопении любого генеза, наследственные или приобретенные ослабления адгезии (болезни фон Виллебранда, Бернара-Сулье, наследственный
геморрагический диатез и др.), ослабленная агрегация или уменьшение секреции тромбоцитов;
3. Недостаточность факторов коагуляции врожденного (гемофилия А по фактору VIII, гемофилия В по фактору IX, болезнь фон Виллебранда, по другим факторам свертывания крови) или чаще приоб
ретенного происхождения (при заболеваниях печени, дефиците витамина К, некоторых иммунных поражениях);
4. Избыточная внутрисосудистая коагуляция, например, при диссеминированном внутрисосудистом свертывании крови - ДВС-синдроме (см. следующую лекцию).
Исход кровоизлияний может быть благоприятным (рассасывание излившейся крови, организация, инкапсуляция, образование “ржавой” кисты) и неблагоприятным (нагноение при присоединении
инфекции).
Значение кровотечения обусловлено его видом, выраженностью и продолжительностью. Так, разрыв сердца при инфаркте миокарда с формированием гемоперикарда быстро приводит к смерти больного, хотя общее количество излившейся крови составляет обычно не более 100-200 г. При артериальном кровотечении может развиться массивная кровопотеря и острое малокровие с летальным исходом.
Длительное небольшое кровотечение из хронической язвы желудка или двенадцатиперстной кишки обусловливает хроническую постгеморрагическую анемию. Значение кровоизлияния зависит прежде
всего от его локализации и лишь затем от его размеров. Даже небольшое кровоизлияние в головной мозг может вызвать поражение жизненно важных центров, отек мозга и смерть больного, тогда как даже
массивные неосложненные кровоизлияния в подкожную клетчатку не представляют опасности для жизни.
Плазморрагия - выход из просвета сосуда плазмы крови с пропитыванием окружающих тканей (плазматическое пропитывание) вследствие повышенной сосудистой проницаемости. Плазморрагия
происходит трансэндотелиально за счет ультрафильтрации (выход плазмы через поры базальной мембраны эндотелия за счет повышения гидростатического или осмотического давления), диффузии (обусловленной градиентом плазменных компонентов в просвете и вне сосуда), микровезикулярного транспорта (микропиноцитоз или цитопемзис, происходящий вследствие активности ферментативных систем эндотелиоцитов). Возможен и интерэндотелиальный выход плазмы. Таким образом, плазморрагия определяется повреждением сосудистой стенки (прежде всего ее интимы) и изменением констант
крови. При морфологическом исследовании стенка сосудов микроциркуляторного русла утолщается, становится гомогенной, а при электронно-микроскопическом исследовании в набухших эндотелиоцитах отмечается большое количество микровезикул, образование фенестр и туннелей, появление межклеточных щелей, разрыхление базальной мембраны интимы. Накопление плазменных компонентов приводит к повреждению клеток и межклеточного вещества как в сосудистой стенке, так и периваскулярных тканях,
в исходе которого развивается гиалиноз, а в тяжелых случаях - фибриноидный некроз.
Артериальное малокровие бывает общим (анемия, рассматриваемая в разделе “Заболевания системы крови”) и местным (ишемия, от греч. ischo - задерживать, останавливать). Ишемия развивается при уменьшении кровенаполнения органов и тканей в результате недостаточного притока крови.
Выделяют четыре разновидности артериального малокровия в зависимости от причин и условий возникновения:
ангиоспастическое артериальное малокровие обусловлено спазмом артерий вследствие нервного, гормонального или медикаментозного воздействия (стресс, стенокардия, аппендикулярная колика и пр.). Имеет большое значение избыточное поступление в кровь вазопрессорных агентов, таких как ангиотензин-1, вазопрессин, катехоламины и пр. Всегда острое по течению;
обтурационное артериальное малокровие развивается из-за полного или частичного закрытия просвета артерии тромбом, эмболом (острое) или атеросклеротической бляшкой, воспалительным процессом (хроническое);
компрессионное артериальное малокровие возникает при остром или хроническом сдавливании сосуда извне (жгут, отек, опухоль и пр.);
артериальное малокровие в результате перераспределения крови формируется при оттоке крови в соседние, ранее ишемизированные, органы и ткани после быстрого удаления асцитической жидкости, большой сдавливающей опухоли и пр. Всегда острое. Развивающиеся в тканях изменения связаны с продолжительностью и тяжестью ишемии, а, следовательно, и гипоксии, чувствительностью органов к недостатку кислорода, наличием коллатеральных сосудов. Так, наиболее чувствительными к артериальному малокровию является головной мозг, почки, миокард, в меньшей степени - легкие и печень, тогда как соединительная, костная и хрящевая ткани отличаются значительной устойчивостью к недостатку кислорода.
Ишемия приводит к распаду в клетках креатининфосфата и АТФ, активизации процессов анаэробного окисления, приводящей к накоплению молочной и пировиноградной кислот (ацидоз), жирных кислот, усиливающей перекисное окисление липидов, повреждающее мембраны митохондрий. Усугубляющийся энергетический дефицит способствует деструкции эндоплазматической сети, накоплению в цитоплазме ионов кальция, в свою очередь активизирующих клеточные фосфолипазы, эндонуклеазы и протеазы, обусловливающие развитие некроза и апоптоза клеток. При ишемии большое значение имеет функциональное состояние органа, определяющее потребность в кислороде, величину обменных процессов. Например, при гипотермии эти показатели снижаются, что используется при операциях на сердце в условиях искусственного кровообращения.
Чем быстрее развивается ишемия, тем значительнее (вплоть до некроза) тканевые изменения пораженных тканей. При хроническом малокровии, как правило, успевает сформироваться коллатеральное кровообращение, снижающее кислородную недостаточность. Следовательно, при острой ишемии развиваются дистрофические и некротические изменения, тогда как при хронической - преобладают
атрофия паренхимы и склероз стромы.
При внешнем осмотре ишемизированные участки отличаются от сохранных некоторой бледностью, иногда практически незаметной. Поэтому для макроскопического выявления ишемии применяют окраску теллуритом калия, придающего тканям, содержащим дыхательные ферменты (дегидрогенезы), сероватый или черный цвет. При этом ишемизированная область, в которой эти ферменты разрушены, становится бледно-серой или белесоватой. Микроскопически ишемия обнаруживается при выявлении гликогена или окислительно-восстановительных ферментов (например, ШИК-реакция, окраска солями тетразолия), исчезающих в пораженных участках.
В последние десятилетия отмечается учащение сегментарного некроза кишечника при полной непроходимости магистральных брыжеечных артерий. Эта патология встречается после тяжелых полостных операций у лиц любого возраста и пола, но особенно часто наблюдается у пожилых больных с хронической ишемической болезнью сердца, злокачественными новообразованиями, обширными травмами и коллаптоидными состояниями различного генеза.
Принятое название “неокклюзионный инфаркт кишечника”, диагностируемый в 20-50% случаев сосудистых поражений кишки, не отражает сути процесса, обусловленного поражением не магистральных артерий, а острой обтурационной ишемией сосудов микроциркуляторного русла вследствие микротромбов капилляров, артериол и венул. Следовательно, это патологическое состояние следует отнести к сосудистому некрозу.
Инфаркт (от лат. infarcire - начинять, набивать) - очаг некроза в ткани или органе, возникающий вследствие прекращения или значительного снижения артериального притока, реже - венозного оттока.
Инфаркт - это сосудистый (дисциркуляторный) некроз. Причинами инфаркта являются тромбоз, эмболия, длительный спазм артерии или функциональное перенапряжение органа в условиях недостаточного кровоснабжения (последнее наблюдается только при инфаркте миокарда).
Форма инфаркта зависит от особенностей строения сосудистой системы того или иного органа, наличия анастомозов, коллатерального кровоснабжения (ангиоархитектоники). Так, в органах с магистральным расположением сосудов возникают треугольные (конусовидные, клиновидные) инфаркты, тогда как при рассыпном или смешанном типе ветвления сосудов наблюдается неправильная форма инфаркта. По внешнему виду выделяют белый и красный инфаркты.
Белый (ишемический, бескровный) инфаркт возникает вследствие поражения соответствующей артерии. Такие инфаркты встречаются в селезенке, головном мозге, сердце, почках и представляют собой в большинстве случаев коагуляционный или реже колликвационный (в головном мозге) некроз. Примерно
через 24 ч от начала развития инфаркта зона некроза становится хорошо видимой, четко контрастирует своим бледно-желтым или бледно-коричневым цветом с зоной сохранной ткани. Между ними располагается демаркационная зона, представленная воспалительной лейкоцитарной и макрофагальной инфильтрацией и гиперемированными сосудами с диапедезом форменных элементов крови вплоть до формирования мелких кровоизлияний. В миокарде и почках вследствие большого количества сосудистых коллатералей и анастомозов демаркационная зона занимает значительную площадь. В связи с этим инфаркт этих органов называют ишемическим с геморрагическим венчиком .
Красный (геморрагический) инфаркт развивается при закупорке артерий и (реже) вен и обычно встречается в легких, кишечнике, яичниках, головном мозге. Большое значение в генезе красного инфаркта имеет смешанный тип кровоснабжения, а также наличие венозного застоя. Так, например, обтурация тромбоэмболом или тромбом ветви легочной артерии вызывает поступление по анастомозам крови в зону пониженного давления из системы бронхиальных артерий с последующим разрывом капилляров межальвео-
лярных перегородок. В очень редких случаях блокирования этих анастомозов (возможно при наличии пневмонии той же локализации) в легком может развиться и белый инфаркт. Также исключительно редко при тромбозе селезеночной вены образуется не белый, а красный (венозный) инфаркт селезенки. Зона некроза пропитывается кровью, придающей пораженным тканям темно-красный или черный цвет. Демаркационная зона при этом инфаркте не выражена, так как занимает небольшую площадь.
В течение нескольких дней сегментоядерные нейтрофилы и макрофаги частично резорбируют некротизированную ткань. На 7-10-й день отмечается врастание из демаркационной зоны грануляционной
ткани, постепенно занимающей всю зону некроза. Происходит организация инфаркта, его рубцевание. Возможен и другой благоприятный исход - образование на месте некроза кисты (полости, иногда
заполненной жидкостью), что часто наблюдается в головном мозге.
При небольших размерах ишемического инсульта (инфаркта мозга) возможно замещение его глиальной тканью с формированием глиального рубца. К неблагоприятным исходам инфаркта относится его