Система ренин ангиотензин в регуляции осмотического давления. Активация ренин-ангиотензин-альдостероновой системы (раас)
Читайте также
играет центральную роль в развитии ренальной гипертензии. Любое повреждение паренхимы почек (склероз, кисты, рубцы, микроангиопатические повреждения, тубуло- интерстициальное или гломерулярное воспаление) вызывает нарушение перфузии гломерул и повышает секрецию ренина.
Гиперренинемия ведет к ангиотензин II-зависимой вазоконстрикции, а также альдостерон-зависимой задержке натрия. Таким образом, повышается и общее периферическое сопротивление, и объем циркулирующей крови. У 90% больных с тХПН АГ носит объем- зависимый характер и у 10% ведущим является повышение активности РАС. Кроме того, высокий уровень ангиотензина II запускает процессы воспаления, гипертрофии миокарда, эндотелиального повреждения, пролиферацию мезангиальных клеток и интерстициальный фиброз.
Существенное влияние на объем внеклеточной жидкости и АД оказывает не контролируемое потребление натрия с пищей. Задержка натрия при ХБП может быть обусловлена как снижением СКФ, так и повышением его реабсорбции в канальцах, не зависящим и не зависящим от активации РААС (при гломерулонефритах с нефротическим синдромом).
У детей с АГ на диализе диурез обычно меньше, чем у нормотензивных пациентов того же возраста, а междиализная прибавка веса умеренно коррелирует с междиализным повышением АД (r=0,41). Нефрэктомия у детей на диализе с ренинзависимой АГ снижает среднее АД, а гипертензия приобретает объем-зависимый характер.
Важным механизмом АГ является повышение активности симпатической нервной системы, отмечающееся у больных с ХБП и особенно при ХПН. Лежащие в основе этого феномена механизмы пока не ясны и могут включать афферентные сигналы от почек, допаминергические нарушения и аккумуляцию лептина. Не только блокада b-рецепторов, но и ингибиция ангиотензин- превращающего фермента (АПФ) может уменьшать симпатическую гиперактивацию при ХБП. Представляется, что ренальная ишемия любого происхождения (в том числе локальная) вызывает симпатическую гиперактивацию.
Препараты, используемые в терапии больных при ХБП, могут вызывать ятрогенную артериальную гипертензию. Например, применение эритропоэтина в течение нескольких недель приводит к подъему АД у 20% больных. Глюкокортикоиды вызывают задержку жидкости за счет их минералокортикоидной активности. Циклоспорин А вызывает повышение гломерулярных афферентных артериол и гиперплазии юкстагломерулярного аппарата с последующим повышенным высвобождением ренина и ангиотензина II.
Таким образом, все дети с ХБП находятся в группе риска по развитию АГ. К группе высокого риска относятся больные с тХПН, реципиенты почечного трансплантата, больные с быстропрогрессирующим гломерулонефритом.
Ранняя диагностика АГ представляется чрезвычайно важной задачей для предупреждения отдаленных последствий гипертензии. С этой целью необходимо применение активных скрининговых методов, так как клинические симптомы АГ часто отсутствуют.
Простейшим скрининговым методом выявления АГ является регулярное измерение артериального давления, по меньшей мере, при каждом осмотре пациента врачом. Диагноз АГ правомерен, если не менее чем при 3-х клинических измерениях АД выше 95 перцентиля для данного возраста и роста. (Приложение 1.). В настоящее время широкое распространение получил метод 24-часового (суточного) мониторирования артериального давления (СМАД).
Это исследование позволяет диагностировать «скрытую гипертензию», т.е. не выявляемую при разовых клинических измерениях АД, например, в ночное время, исключить гипертензию «белого халата», которая встречается даже у детей, длительно находящихся в стационаре. В последнем случае целесообразно проведение СМАД амбулаторно, когда ребенок на протяжении исследования находится в привычной ему домашней обстановке.
Проведение СМАД показано всем детям с ХБП ежегодно. В случае выявления АГ необходимо также проведение офтальмологического осмотра (для оценки состояния сосудов сетчатки) и эхокардиографии (для исключения систолической и диастолической дисфункции, оценки степени гипертрофии миокарда). В дальнейшем эти исследования должны выполняться не реже 1 раза в год.
Основной целью антигипертензивной терапии является предупреждение повреждения органов-мишеней (особенно гипертрофии левого желудочка) и замедление прогрессирования ХБП. Всем детям с ХБП, осложненной АГ, показана антигипертензивная терапия до достижения уровня АД ниже 90 перцентиля для данного возраста и роста.
Терапия АГ включает в себя коррекцию образа жизни и диеты и медикаментозное лечение.
В рационе детей с ХБП, осложненной АГ, прежде всего, необходимо ограничить потребление натрия до 1-2 г/сут. Пища готовится без добавления соли, которая выдается дозировано для досаливания еды в тарелке, должны быть исключены все продукты с высоким содержанием натрия (консервы, колбасные изделия, ржаной хлеб и т.п.). Такого рода ограничения часто тяжело переносятся пациентами, но, неконтролируемое потребление натрия значительно снижает эффективность медикаментозной антигипертензивной терапии.
Ожирение не характерно для детей с ХБП и обычно связано с лечением стероидами. Постепенное снижение массы тела на фоне низкокалорийной диеты и дозированных физических нагрузок способствует нормализации АД. На практике применение низкокалорийной диеты затруднено из-за уже имеющихся у детей с ХБП диетических ограничений, и она редко оказывается эффективной. Тем не менее, у тучных детей с задержкой натрия может быть полезна комбинированная низкокалорийная диета с пониженным содержанием натрия.
У больных с АГ, получающих ЗПТ, изменение диализного режима может улучшить контроль АД до начала фармакологического лечения. В большинстве случаев, у диализных больных можно добиться нормализации показателей АД адекватной продолжительностью диализа, тщательным контролем баланса внеклеточной жидкости, более агрессивным достижением сухого веса. Считается, что сокращение натрия в диете в сочетании с низким натрием в диализате сравнимо по эффективности с увеличением диализного времени и позволяет добиться умеренного снижения АД.
На всех стадиях ХБП основой антигипертензивной терапии является фармакологическое лечение. Контроль АД ниже 90 перцентиля может быть достигнут монотерапией не более чем у 75% детей с ХБП 2-ой стадии. У остальных больных необходимо применение 2-х и более лекарственных препаратов. У детей с тХПН трудно достичь адекватного контроля АД, у 50% детей на диализе наблюдается неконтролируемая гипертензия.
У детей с АГ рекомендуется начинать лечение с одного препарата в низкой или средней терапевтической дозе и постепенно повышать ее до достижения контроля АД. При отсутствии достаточного эффекта от монотерапии показано использование комбинации из 2-х и более препаратов. Исключение - неотложные состояния при АГ, такие как гипертонический криз, гипертоническая энцефалопатия, когда лечение следует начинать с внутривенного введения препаратов до достижения клинического эффекта.
В настоящее время в терапии артериальной гипертензии используется широкий спектр лекарственных средств (Табл.2.1).
В первую очередь применяются препараты следующих групп:
· Ингибиторы ангиотензин-превращающего фермента (иАПФ)
· Блокаторы рецепторов к ангиотензину II (БРА)
· Блокаторы кальциевых каналов
· β - адреноблокаторы
· диуретики
К препаратам резерва относятся:
· α β – адреноблокаторы
· центральные α – антагонисты
· периферические α - антагонисты
· периферические вазодилататоры.
У детей с хронической патологией почек начинать терапию наиболее целесообразно с иАПФ или БРА. Эти препараты не только обладают гипотензивным действием, но и замедляют прогрессирование почечной недостаточности более эффективно, чем препараты других фармакологических групп. Ренопротективный эффект блокады РААС обусловлен снижением внутриклубочковой гипертензии путем избирательной дилатации эфферентной артериолы, снижением протеинурии, а также ослаблением провоспалительного и просклеротического действия ангиотензина II. Дополнительный эффект блокады РААС заключается в снижении симпатической гиперактивности.
Поскольку протеинурия является независимым фактором прогрессирования ХБП, пациенты с ХБП и протеинурией должны получать блокаторы РААС даже при отсутствии АГ. Не выявлено отчетливых преимуществ применения БРА перед иАПФ. Если протеинурия сохраняется на фоне монотерапии, то возможно применение комбинации иАПФ и БРА, так как это сочетание эффективно для уменьшения протеинурии и замедления прогрессирования ХБП.
Применение ингибиторов АПФ и БРА противопоказано пациентам со снижением СКФ ≤ 20 мл/мин, при гиперкалиемии, и при двустороннем стенозе почечных артерий. При назначении препаратов этих групп детям с ХБП 3-4 стадии необходимо контролировать уровень азотемии и калия после начала терапии и при каждом повышении дозы. Терапия комбинацией иАПФ и БРА повышает риск падения клубочковой фильтрации и гиперкалиемии. У детей с ХПН целесообразным может быть применение фозиноприла (моноприла), т.к. этот препарат (в отличие от других и АПФ) метаболизируется в основном в печени, а не выводится с мочой и более безопасен для больных с существенным нарушением почечных функций. Отмечено, что кашель, индуцированный иАПФ, у детей встречается реже, чем у взрослых; при возникновении этого побочного эффекта возможна замена иАПФ на БРА.
b-блокаторы – препараты второй линии для лечения детей с почечной гипертензией. b-блокаторы должны с осторожностью использоваться при сердечной недостаточности, а также у больных сахарным диабетом из-за негативных метаболических эффектов. Неселективные b-блокаторы противопоказаны при заболеваниях легких, сопровождающихся бронхообструкцией. У грудных детей хороший эффект оказывает назначение пропранолола. Ретардированная форма этого препарата позволяет назначать его 1 раз в день у старших детей. Предпочтительнее назначение селективных b1-блокаторов, например атенолола, который также обладает пролонгированным действием.
Применение b-блокаторов показано при наличии симптомов гиперактивации симпатической нервной системы: тахикардии, вазоконстрикции, высокого сердечного.
Блокаторы кальциевых каналов (БКК) используются как дополнительная терапия у детей с резистентной гипертензией. Дигидропиридиновые препараты (нифедипин, амлодипин и т.д.) действуют главным образом как вазодилататоры. Дозы амлодипина разработаны для педиатрии и не требуют коррекции в зависимости от почечной функции, однако дигидропиридиновые БКК (нифедипин) повышают внутриклубочковое давление и могут повышать протеинурию, не оказывая, следовательно, ренопротективного действия. Недигидропиридиновые БКК (производные фенилалкиламина - верапамил, бензодиазепина - дилтиазем) обладают дополнительным антипротеин- урическим эффектом.
В исследованиях у пожилых больных с сахарным диабетом 2 типа, недигдропиридиновые БКК показали себя как действенное средство в снижении протеинурии и АД и замедлении прогрессирование ХБП, их эффективность в этом отношении оказалась сравнима с иАПФ - лизиноприлом. Поскольку среди детей подобных исследований не проводилось, в детском возрасте недигдропиридиновые БКК должны применяться с осторожностью, учитывая их побочные эффекты (удлинение интервала PQ, брадиаритмии).
В исследованиях у больных с сахарным диабетом, АГ и протеинурией комбинация иАПФ с дигидропиридиновым БКК III поколения – манидипином - оказывала дополнительный антипротеинурический эффект по сравнению с монотерапией иАПФ. Показано благоприятное воздействие манидипина на почечную гемодинамику и протеинурию.
Внутривенное введение никардипина является методом выбора для лечения гипертонического криза, особенно в тех случаях, когда почечная функция не известна или быстро изменяется. Этот препарат может безопасно использоваться даже у очень маленьких детей с АГ.
Диуретики показаны, прежде всего, пациентам с задержкой натрия, гиперволемией и отеками и не являются препаратами первой линии в терапии АГ у детей с ХБП. Необходимо помнить, что тиазидные диуретики становятся малоэффективными при СКФ
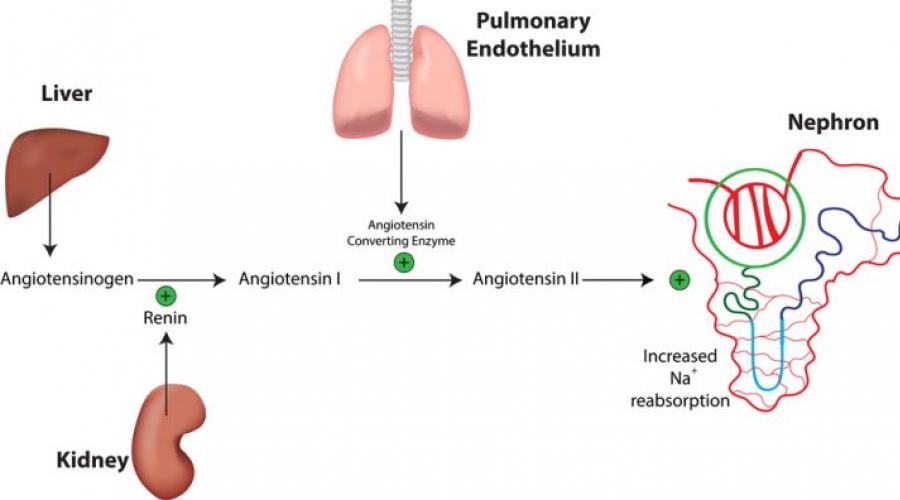
Ренин
– фермент, синтезируемый юкстагломерулярными клетками почечных афферентных артериол, имеющий ММ около 40 кДа. Особенно интенсивно образование ренина происходит при ишемии почек. Локализация юкстагломерулярных клеток делает их особенно чувствительными к изменениям кровяного давления, а также концентрации ионов Na + и К + в жидкости, протекающей через почечные канальцы. Благодаря указанным свойствам любая комбинация факторов, вызывающая снижение объема жидкости (обезвоживание, падение кровяного давления, кровопотеря и др.) или снижение концентрации NaCl, стимулирует высвобождение ренина.
В то же время большинство регуляторов синтеза ренина действуют через почечные барорецепторы. На освобождение ренина оказывает влияние состояние ЦНС, а также изменение положения тела в пространстве. В частности, при переходе из положения лёжа в положение сидя или стоя (клиностатическая проба) секреция ренина увеличивается. Эта рефлекторная реакция обусловлена повышением тонуса симпатической части автономной нервной системы, передающей импульсы к b-адренорецепторам юкстагломерулярных клеток.
Основным субстратом, на который воздействует ренин, является ангиотензиноген – белок, входящий во фракцию a 2 -глобулинов и образуемый печенью. Под воздействием глюкокортикоидов и эстрогенов синтез ангиотензиногена значительно возрастает. В результете действия ренина ангиотензиноген превращается в декапептид ангиотензин I. Это соединение обладает чрезвычайно слабым действием и существенного влияния на уровень кровяного давления не оказывает.
Между тем ангиотензин I под воздействием так называемого ангиотензинпревращающего фермента (АПФ) переходит в мощный сосудосуживающий фактор – ангиотензин II. АПФ (дипептидкарбооксипептидаза) является интегральным белком, расположенным преимущественно на мембране эндотелиальных клеток, эпителии, мононуклеарах, нервных окончаниях, клетках репродуктивных органов и др. Растворимая форма АПФ присутствует практически во всех жидкостях организма.
Принято выделять две изоформы АПФ. Первая из них получила условное наименование «соматической». Эта изоформа имеет ММ 170 кДа и включает гомологичные С- и N-домены. Вторая форма АПФ («репродуктивная») найдена в семенной жидкости, имеет ММ около 100 кДа и соответствует С-домену первой изоформы АПФ. Каждый из 2 указанных доменов содержит аминокислотные остатки, которые могут принимать участие в образовании связи с атомом цинка. Такие Zn 2+ -структуры являются типичными для многих металлопротеиназ и оказываются основными участками взаимодействия фермента как с субстратом, так и с ингибиторами АПФ.
Следует заметить, что АПФ не только приводит к образованию ангиотензина II, но и разрушает брадикинин – соединение, расширяющее кровеносные сосуды. Следовательно, увеличение кровяного давления при воздействии АПФ связано как с образованием ангиотензина II, так и с распадом брадикинина (рис. 32).
Важную роль для действия АПФ играет ионный состав и, в частности, содержание ионов хлора. Так, при высокой концентрации Cl – С-домен АПФ гидролизует и брадикинин, и ангиотензин-I быстрее, чем N-домен. Во внеклеточных регионах, где концентрация анионов хлора высока, за превращение ангиотензина-I отвечает преимущественно N-домен. Однако внутриклеточно, где концентрация Cl – низкая, N-домен может участвовать в гидролизе других пептидных субстанций.
За последние годы установлено, что АПФ играет важную роль в гемопоэзе, ибо под его воздействием ингибируется образование гематопоэтического пептида , тормозящего образование гематопоэтических клеток костного мозга.
Роль АПФ в организме была выявлена на мышах, лишенных гена АПФ. У таких животных отмечалось низкое кровяное давление, различные сосудистые дисфункции, нарушение структуры и функции почек и бесплодие у самцов.
Ангиотензин II
увеличивает кровяное давление, вызывая сужение артериол, и является самым сильнодействующим из известных вазоактивных агентов. Кроме того, он по механизму обратной связи тормозит образование и высвобождение ренина юкстагломерулярными клетками почки, что в конечном итоге должно восстанавливать нормальный уровень кровяного давления. Под воздействием ангиотензина II резко возрастает продукция основного минералокортикоида – альдостерона. Несмотря на то, что это действие является прямым, ангиотензин II не влияет на продукцию кортизола. Основное назначение альдостерона сводится к задержке Na + (за счет усиления его реабсорбции в почечных канальцах) и выделению К + и Н + (главным образом через почки). Эти реакции осуществляются следующим образом.
Альдостерон
проникает из внеклеточной жидкости в цитоплазму клетки и там соединяется со специфическим рецептором, после чего образовавшийся комплекс (альдостерон+рецептор) проникает в ядро. Альдостерон также стимулирует открытие Na + каналов, благодаря чему ионы Na + входят в клетку через апикальную мембрану из просвета канальца.
Увеличение секреции К + под воздействием альдостерона обусловлено возрастанием проницаемости апикальной мембраны по отношению к этим ионам, благодаря чему К + поступает из клетки в просвет канальца.
Задержка Na + в организме, как и ангиотензин II, способствует повышению кровяного давления.
Ангиотензин II способен связываться со специфическими рецепторами клубочковых клеток надпочечника. Содержание этих рецепторов во многом зависит от концентрации ионов К + . Так, если уровень К + повышается, то возрастает число рецепторов к ангиотензину II в клубочковых клетках. При уменьшении концентрации ионов К + отмечается прямо противоположный эффект. Следовательно, ионы К + играют основную роль в действии ангиотензина II на надпочечники.
За последнее время установлено, что ангиотензин II способен активировать макрофаги, благодаря чему усиливается агрегация тромбоцитов и ускоряется свёртывание крови. Одновременно при этом высвобождается ингибитор активатора плазминогена- I (ИАП-1), что может сопровождаться депрессией фибринолиза. Ангиотензин II является одним из факторов, способствующих развитию атерогенеза, торможению апоптоза и усилению оксидативного стресса в тканях, тем самым провоцируя агрегацию тромбоцитов и тромбообразование.
Ангиотензин II способен усиливать функцию миокарда, участвует в биосинтезе норадреналина и других физиологически активных веществ. Одновременно он может действовать как ростовой фактор, приводя к сосудистой и сердечной гипертрофии.
У некоторых животных и у человека ангиотензин II под воздействием фермента аминопептидазы превращается в гептапептид ангиотензин III. У человека уровень ангиотензина II приблизительно в 4 раза выше, чем ангиотензина III. Оба эти соединения оказывают влияние на уровень кровяного давления и продукцию альдостерона и довольно быстро разрушаются под воздействием ферментов ангиотензиназ.
При тяжелых заболеваниях почек, сопровождающихся их ишемией, благодаря повышенному образованию и секреции ренина наблюдается стойкое повышение кровяного давления (почечная гипертензия). Применение ингибиторов АПФ в этих условиях приводит к быстрой нормализации кровяного давления.
В заключение следует еще раз подчеркнуть, что ангиотензин-ренино-альдостероновая система теснейшим образом связана с функцией калликреин-кининовой системы, ибо образование ангиотензина II и разрушение брадикинина осуществляется под воздействием одного и того же фермента – АПФ.
Ренин-ангиотензин-альдостероновая система (РААС) выполняет важное гуморальное влияние на сердечно-сосудистую систему и участвует в регуляции артериального давления. Центральным звеном РААС является ангиотензин II (АТ II) (схема 1), который обладает мощным прямым вазоконстрикторным действием преимущественно на артерии и опосредованным действием на ЦНС, высвобождением катехоламинов из надпочечников и вызывает увеличение ОПСС, стимулирует секрецию альдостерона и приводит к задержке жидкости и повышению (ОЦК), стимулирует выброс катехоламинов (норадренолина) и других нейрогормонов из симпатических окончаний. Влияние АТ II на уровень АД осуществляется за счет действия на тонус сосудов, а также посредством структурной перестройки и ремоделирования сердца и сосудов. В частности, ATII является также фактором роста (или модулятором роста) для кардиомиоцитов и гладкомышечных клеток сосудов.
Схема 1. Строение ренин-ангиотензин-альдостероновой системы
Функции других форм ангиотензина. Ангиотензин I малозначим в системе РААС, так как быстро превращается в АТП, кроме того, его активность в 100 раз меньше активности АТП. Ангиотензин III действует подобно АТП, но его прессорная активность в 4 раза слабее АТП. Ангиотензин 1-7 образуется вследствие превращения ангиотензина I. По функциям он значительно отличается от АТП: он не вызывает прессорного действия, а наоборот, приводит к снижению АД благодаря секреции АДГ, стимуляции синтеза простагландинов, натрийуреза.
РААС оказывает регулирующее влияние на почечную функцию. АТП вызывает мощный спазм приносящей артериолы и снижение давления в капиллярах клубочка, уменьшение фильтрации в нефроне. В результате снижения фильтрации уменьшается реабсорбция натрия в проксимальном отделе нефрона, что приводит к увеличению концентрации натрия в дистальных канальцах и активации Na-чувствительных рецепторов плотного пятна в нефроне. По меха-низму обратной связи это сопровождается торможением выделения ренина и увеличением скорости клубочковой фильтрации.
Функционирование РААС связано с альдостероном и посредством механизма обратной связи. Альдостерон - важнейший регулятор объема внеклеточной жидкости и гомеостаза калия. Прямого действия на секрецию ренина и АТП альдостерон не оказывает, но возможно косвенное влияние через задержку натрия в организме. В регуляции секреции альдостерона участвуют АТП и электролиты, причем АТП - стимулирует, а натрий и калий - уменьшают его образование.
Гомеостаз электролитов тесно связан с активностью РААС. Натрий и калий не только влияют на активность ренина, но и изменяют чувствительность тканей к АТП. При этом в регуляции активности ренина большая роль принадлежит натрию, а в регуляции секреции альдостерона - калий и натрий имеют одинаковые влияния.
Физиологическая активация РААС наблюдается при потере натрия и жидкости, значительном снижении АД, сопровождающемся падением фильтрационного давления в почках, повышении активности симпатической нервной системы, а также под воздействием многих гуморальных агентов (вазопрессина, предсердного натрийуретического гормона, антидиуретического гормона).
Целый ряд сердечно-сосудистых заболеваний может способствовать патологической стимуляции РААС, в частности, при АГ, застойной сердечной недостаточности, остром инфаркте миокарда.
В настоящее время известно, что РАС функционирует не только в плазме (эндокринная функция), но и во многих тканях (головном мозге, сосудистой стенке, сердце, почках, надпочечниках, легких). Эти тканевые системы могут работать независимо от плазменной, на клеточном уровне (паракринная регуляция). Поэтому различают краткосрочные эффекты ATII, обусловленные свободно циркулирующей его фракцией в системном кровотоке, и отсроченные эффекты, регулируемые через тканевые РАС и влияющие на структурно-адаптационные механизмы поражения органов.
Ключевым ферментом РААС является ангиотензин-превращающий фермент (АПФ), он обеспечивает превращение ΑTI в ATII. Основное количество АПФ присутствует в системном кровотоке, обеспечивая образование циркулирующего АТII и краткосрочные геодинамические эффекты. Превращение АТ в ATII в тканях может осуществляться не только с помощью АПФ, но и другими ферментами (химазы, эндопероксиды, катепсин G и др.); считают, что им принадлежит ведущая роль в функционировании тканевых РАС и развитии длительных эффектов моделирования функции и структуры органов-мишеней.
АПФ идентичен ферменту кининазе II, участвующему в деградации брадикинина. Брадикинин - мощный вазодилататор, участвующий в регуляции микроциркуляции и ионном транспорте. Брадикинин имеет очень короткий период жизни и присутствует в кровотоке (тканях) в низких концентрациях; поэтому он проявлят свои эффекты как местный гормон (паракринно). Брадикинин способствует увеличению внутриклеточного Са 2 +, являющегося кофактором для NO-синтетазы, участвующей в образовании эндотелийрелаксирующего фактора (оксида азота или NO). Эндотелийрелаксирующий фактор, блокирующий сокращение мускулатуры сосудов и агрегацию тромбоцитов, является также ингибитором митоза и пролиферации гладкой мускулатуры сосудов, что обеспечивает антиатерогенное действие. Брадикинин также стимулирует синтез в эндотелии сосудов ПГЕ2 и ПГI2 (простациклина) - мощных вазодилататоров и тромбоцитарных антиагрегантов.
Таким образом, брадикинин и вся кининовая система являются противодействующей для РААС. Блокирование АПФ потенциально повышает уровень кининов в тканях сердца и сосудистой стенки, что обеспечивает антипролиферативный, антиишемический, антиатерогенный и антиагрегантный эффекты. Кинины способствуют увеличению кровотока, диуреза и натрийуреза без существенного изменения скорости клубочковой фильтрации. ПГ Е2 и ПГI2 также обладают диуретическим и натрийуретическим действием и увеличивают почечный кровоток.
Который образуется в особых клетках юкстагломерулярного аппарата почки (ЮГА). Секрецию ренина стимулируют уменьшение объёма циркулирующей крови, снижение кровяного давления, b 2 -агонисты, простагландины Е 2 , I 2 , ионы калия. Повышение активности ренина в крови вызывает образование ангиотензина I - это пептид из 10 аминокислот, который отщепляется от ангиотензиногена. Ангиотензин I при действии ангиотензинпревращающего фермента (АПФ) в легких и в плазме крови переходит в ангиотензи II.
Он вызывает синтез в клубочковой зоне коры надпочечников гормона альдостерона. Альдостерон поступает в кровь, переносится к почке и действует через свои рецепторы на дистальные канальцы мозгового вещества почки. Суммарный биологический эффект альдостерона - задержка NaCl, воды. В результате восстанавливается объём жидкости, циркулирующей в кровеносной системе, в том числе увеличивается почечный кровоток. Это замыкает отрицательную обратную связь и синтез ренина прекращается. Помимо этого, альдостерон вызывает потерю с мочой Mg 2+ , K + , H + .В норме эта система поддерживает артериальное давление (рис.25).
Рис. 25. Ренин-ангиотензин-альдостеровая система
Избыток альдостерона - альдостеронизм , бывает первичным и вторичным. Первичный альдостеронизм может быть вызван гипертрофией клубочковой зоны надпочечников, эндокринной эпатологией, опухолью (альдостеронома). Вторичный альдостеронизм наблюдается при заболеваниях печени, (альдостерон не обезвреживается и не выводится), или при заболеваниях сердечно-сосудистой системы, в результате которых ухудшается кровоснабжение почки.
Результат одинаковый - гипертензия, а при хроническом процессе альдостерон вызывает пролиферацию, гипертрофию и фиброз сосудов и миокарда (ремоделирование), что ведет к хронической сердечной недостаточности. Если она связана с избытком альдостерона, назначают блокаторы рецепторов альдостерона. Например, спиронолактон, эплеренон это калийсберегающие диуретики, они способствуют выведению натрия и воды.
Гипоальдостеронизм - недостаток альдостерона, возникает при некоторых заболеваниях. Причинами первичного гипоальдостеронизма могут быть туберкулез , аутоиммунное воспаление надпочечников, метастазы опухолей, резкая отмена стероидов. Как правило, это недостаточность всей коры надпочечников. Острая недостаточность может быть вызвана некрозом клубочковой зоны, кровоизлиянием или острой инфекцией. У детей может наблюдаться молниеносная форма при многих инфекционных заболеваниях (грипп, менингит), когда ребёнок может умереть за одни сутки.
При недостаточности клубочковой зоны снижается реабсорбция натрия, воды, падает объём циркулирующей плазмы; увеличивается реабсорбция К + , Н + . В результате резко снижается АД, нарушается электролитный баланс и кислотно-щелочное равновесие, состояние опасно для жизни. Лечение: внутривенное введение солевых растворов и агонисты альдостерона (флудрокортизон).
Ключевое звено в РААС - это ангиотензин II, который:
Действует на клубочковую зону и увеличивает секрецию альдостерона;
Действует на почку и вызывает задержку Na + , Cl - и воды;
Действует на симпатические нейроны и вызывает освобождение норадреналина, мощного вазоконстриктора;
Вызывает вазоконстрикцию - суживает сосуды (в десятки раз активнее норадреналина);
Стимулирует солевой аппетит и жажду.
Таким образом, эта система приводит АД к норме при его снижении. Избыток ангиотензина II влияет на сердце, так же как и избыток КА и тромбоксанов, вызывает гипертрофию и фиброз миокарда, способствует гипертонии и хронической сердечной недостаточности.
При повышении АД начинают работать в основном три гормона: НУП (натрийуретические пептиды), дофамин, адреномедуллин. Их эффекты противоположны эффектам альдостерона и АТ II. НУП вызывают экскрецию Na + , Cl - , H 2 O, вазодилатацию, увеличивают проницаемость сосудов и снижают образование ренина.
Адреномедуллин действует так же, как НУП: это экскреция Na + , Cl - , H 2 O, вазодилатация. Дофамин синтезируется проксимальными канальцами почек, действует как паракринный гормон. Его эффекты: экскреция Na + и Н 2 О. Дофамин снижает синтез альдостерона, действие ангиотензина II и альдостерона, вызывает вазодилатацию и увеличение почечного кровотока. В совокупности эти эффекты приводят к снижению АД.
Уровень артериального давления зависит от многих факторов: работы сердца, тонуса периферических сосудов и их эластичности, а также от объёма электролитного состава и вязкости циркулирующей крови. Всё это контролируется нервной и гуморальной системой. Гипертоническая болезнь в процессе хронизации и стабилизации связана с поздними (ядерными) эффектами гормонов. При этом возникают ремоделирование сосудов, их гипертрофия и пролиферация, фиброз сосудов и миокарда.
В настоящее время эффективными гипотензивными лекарствами являются ингибиторы вазопептидаз АПФ и нейтральной эндопептидазы. Нейтральная эндопептидаза участвует в разрушении брадикинина, НУП, адреномедуллина. Все три пептида являются вазодилататорами, снижают АД. Например, ингибиторы АПФ (периндо-, эналоприл) снижают АД, уменьшая образование АТ II и задерживая распад брадикинина.
Открыты ингибиторы нейтральной эндопептидазы (омапатрилат), являющиеся одновременно ингибиторами АПФ и нейтральной эндопептидазы. Они не только снижают образование АТ II, но и предотвращают распад гормонов, снижающих АД - адреномедуллина, НУП, брадикинина. Ингибиторы АПФ не полностью выключают РААС. Более полного выключения этой системы можно достигнуть блокаторами рецепторов ангиотензина II (лозартан, эпросартан).
Ещё в конце ХІХ века стало известно, что почки принимают активное участие в регуляции артериального давления. Они вырабатывают фермент – ренин, который с ангиотензином и альдостероном составляет РААС (ренин-ангиотензин-альдостероновую систему). Они влияют на водно-солевой обмен, артериальное давление (именно поэтому различные патологии почек сопровождаются ) и выполняют другие функции.
Что такое ренин-ангиотензин-альдостероновая система
Принцип действия РААСКазалось бы, ренин – фермент, вырабатываемый почками, ангиотензиноген – гликопротеид, синтезируемый печенью, а альдостерон вообще гормон надпочечников – что между ними общего. Тем не менее, они составляют единую систему, которая запускается выработкой ренина в юкстагломерулярных клетках почек.
Существует несколько механизмов стимуляции синтеза фермента:
- Макулярный. Он срабатывает, если снижается поступление ионов натрия в дистальном извитом канальце.
- Внутрипочечный барорецепторный. Юкстагломерулярные клетки являются барорецепторами, они воспринимают растяжение стенок артериол, соответственно реагируют на снижение давления выработкой ренина.
- Симпатический. Юкстагломерулярные клетки иннервируются симпатической нервной системой, и как только к ним поступает сигнал, они тут же начинают синтезировать фермент, способствующий повышению давления. Именно поэтому при стрессах, психо-эмоциональных нагрузках возникает артериальная гипертензия.
Затем ренин поступает в кровь. Там он воздействует на гликопротеин ангиотензиноген, вырабатываемый печенью. Таким образом, ангиотензиноген превращается в ангиотензин І. Под влиянием ангиотензинпревращающего фермента (АПФ) отщепляется дипептид у ангиотензина І, и он становится самым мощным сосудосуживающим средством – ангиотензином ІІ. Кроме того, что он вызывает спазм гладкой мускулатуры, тормозит выработку брадикинина, он стимулирует синтез альдостерона. Этот гормон, вырабатываемый надпочечниками:
- удерживает ионы натрия и воду;
- выводит калий;
- усиливает синтез АТФ-азы воздействуя на ДНК.
Как только нормализуется концентрация натрия в крови, прекращается выработка ренина. Все продукты реакций распадаются, давление нормализуется, и начинают синтезироваться вазодилататоры:
- брадикинин;
- каллидин.
Стимулироваться работа ренин-ангиотензин-альдостероновой системы может из-за различных патологий. Например, при стенозе почечной артерии запускается РААС. Из-за того, что вырабатывается эффективнейший вазоконстриктор ангиотензин ІІ, возникает спазм сосудов. А это приводит к неоправданной гипертонии. Давление значительно повышается, соответственно нарушается микроциркуляция крови. К органам приносится меньшее количество питательных веществ, жизненно необходимых микроэлементов и кислорода (без него клетки мозга начинают отмирать через 5 минут).
Функции РААС
Как только в дистальных канальцах почек понижается концентрация ионов натрия, на юкстагломерулярные клетки подаётся сигнал от симпатической нервной системы, барорецепторы реагируют на расширение стенки артериол, тут же включается ренин-ангиотензин-альдостероновая система. Все реакции происходят практически мгновенно, но даже за столь незначительное время РААС справляется со своими функциями:
- поддерживает кислотно-щелочной баланс;
- регулирует водно-солевой обмен;
- влияет на восстановление объёма крови;
- усиливает скорость клубочковой фильтрации.
На протекание химических реакций влияет кислотно-щелочной баланс. В организме он поддерживается благодаря работе почек, буферных систем и лёгких. Если в крови понижается концентрация натрия, запускается РААС. Под влиянием альдостерона ионы возвращаются в кровь и соединяются с анионами, тем самым создают щелочную среду. Из организма выводятся кислоты в виде аммонийных солей (мочевины). Этот процесс способствует сохранению в организме необходимых минералов (натрия, калия, магния) и выведению токсинов.
Как только под влиянием РААС в крови из-за увеличения солей повышается осмотическое давление, стимулируется выработка вазопрессина, оказывается влияние на синтез альдостерона.
- При понижении концентрации хлорида натрия под воздействием гормонов удерживается в организме натрий и выводится вода. Так в организме сохраняется необходимое количество солей.
- Как только концентрация хлорида натрия повысилась, перестаёт работать РААС. В почечных клубочках происходит выведение избытка солей из организма.
Таким образом регулируется водно-солевой обмен и тем самым поддерживается:
- необходимый объём крови;
- нормальная концентрация натрия.
Кроме вазопрессина и альдостерона регуляцию водно-солевого баланса осуществляет и ангиотензин. Когда количество воды в крови снижается, он сужает стенки сосудов, чтобы временно поддержать нормальное артериальное давление (если объём крови недостаточный, возникает гипотензия) и обеспечить все органы необходимыми веществами. Также он влияет на центр жажды, расположенный в 3 желудочке головного мозга, из-за чего начинает хотеться пить. Как только в организм поступает необходимая жидкость и соли, перестаёт вырабатываться ренин. На этом работа РААС временно прекращается.
Если в организме произошёл сбой ренин-ангиотензин-альдостероновой системы, например, из-за:
- стеноза почечной артерии;
- и др. патологий.
Это приведёт к тому, что будет постоянно повышенное давление.
Кроме того, ангиотензин ІІ оказывает прямое воздействие на центральную нервную систему, возникает импульс, который буквально даёт команду гладкой мускулатуре сократиться. Сжимаются стенки сосудов, учащается сердцебиение, поднимается артериальное давление.
Изучение механизма действия РААС привело к тому, что были изобретены эффективные :
- блокаторы рецепторов к ангиотензину;
- ингибиторы АПФ.
Все эти медикаменты влияют на отдельные элементы цепочки выработки ренина, превращения ангиотензина, синтеза альдостерона. Естественно, они негативно влияют на работу системы и способствуют понижению артериального давления.
Вывод
 Механизм действия РААС
Механизм действия РААС РААС принимает активное участие в водно-солевом обмене, поддержании нормального давления и кислотно-щелочного баланса в крови. За считанные доли секунд вырабатывается ренин, ангиотензин и альдостерон, которые регулируют постоянный объём крови и необходимую концентрацию воды и солей. Однако и эта система может давать сбои, возникающие из-за болезней почек, надпочечников, а это приводит к патологическому повышению давления. Вот поэтому при гипертензии обязательно необходима консультация уролога, нефролога.
Общий видеообзор ренин-ангиотензин-альдостероновой системы: