Лекарственные средства на основе олигонуклеотидов. Симпозиум «Инновационные лекарственные средства на основе пептидов и белков
Читайте также
5507 0
Этого можно достичь несколькими способами: гибридизацией соответствующего олигонуклеотида со специфическим геном или мРНК, блокированием фактора транскрипции белка, уменьшением количества мРНК в результате расщепления РНК-ферментами и т.п. Рассмотрим принципы некоторых из них.
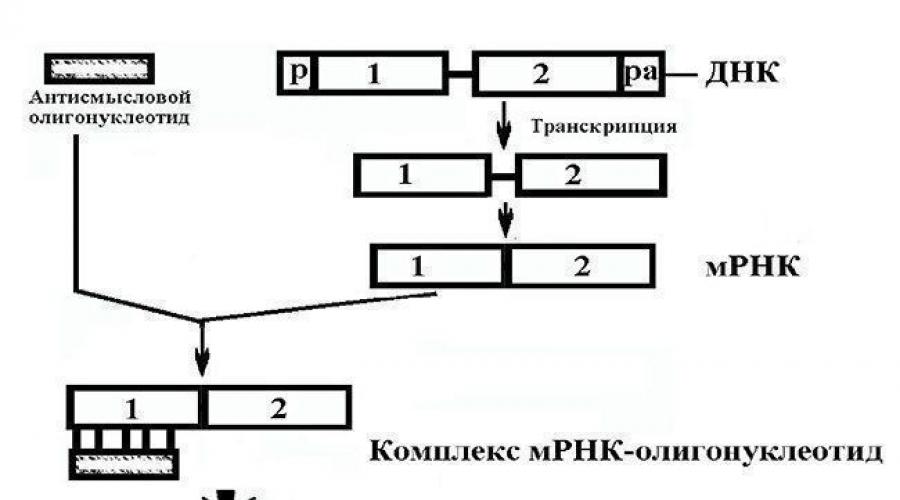
Рибоолигонуклеотид, который связывается с определенной мРНК и тем самым ингибирует трансляцию кодируемого ею белка, называется «антисмысловой» мРНК. Этот механизм используют некоторые бактерии для регулирования генов (рис. 3.20). На практике применяют искусственно сконструированные гены, у которых ДНК-вставка находится в такой ориентации, чтобы их транскрипты были антисмысловыми по отношению к мРНК-мишени (рис. 3.21).
Рис. 3.20. Регулирование гена бактериоферритина (bfr) с помощью антисмысловой РНК

Рис. 3.21. Ингибирование трансляции мРНК синтетическим антисмысловым олигонуклеотидом
Было показано, что возможно использование синтетических антисмысловых олигонуклеотидов, однако их терапевтический эффект будет сильно зависеть от их устойчивости к действию клеточных нуклеаз, системы доставки и специфичности их гибридизации. Для определения наиболее эффективных сайтов-мишеней на специфической мРНК производят тестирование набора антисмысловых олигонуклеотидов длиной 15-20 оснований с культурой клеток, синтезирующих мРНК-мишень. Состав синтезированных белков определяют электрофорезом и устанавливают, введение какого олигонуклеотида приводит к снижению синтеза белка-мишени.
Для защиты от нуклеазного расщепления синтезируются модифицированные олигонуклеотиды, при этом не утратившие способность гибридизоваться. На рис. 3.22 приведены структуры модифицированных нуклеотидов, эффективность которых интенсивно изучается. Например, показано, что олигонуклеотиды с заменой свободного кислорода фосфодиэфирной связи на серу (структура б) эффективно гибридизуются с комплементарной РНК-мишенью и полученные РНК-ДНК дуплексы активируют внутриклеточную рибонуклеазу Н.
Этот эндогенный фермент, гидролизует РНК-последовательность в таких гибридах. С такими олигонуклеотидами уже проведены многообещающие клинические испытания, в которых мишенями являлись РНК цитомегаловируса, ВИЧ, некоторых РНК, ответственных за развитие рака.

Рис. 3.22. Модификации олигонуклеотидов: а - нормальная фосфодиэфирная связь; б - тиофосфатная связь; в - фосфамидная связь; г - 2"-0-метилрибоза; д - С-5-пропинилцитозин
Для эффективной доставки антисмысловых олигонуклеотидов их часто пакуют в липосомы, в свою очередь модифицированные специфическими лигандами, обеспечивающими адресную доставку (такой прием мы уже встречали, когда рассматривали способы невирусной доставки терапевтических генов). К настоящему времени проведен ряд испытаний и показана высокая терапевтическая эффективность антисмысловых олигонуклеотидов для подавления нежелательной пролифирации гладкомышечных клеток (осложнения после ангинопластики, коронарного шунтирования, атеросклероз), для лечения вирусных инфекций и малярии.
Принцип действия и строение рибозимов - природных РНК, обладающих нуклеазной активностью, показан на рис. 3.23.
Обнаружено, что эти короткоцепочечные РНК способны эффективно подавлять экспрессию вирусных генов, онкогенов, факторов роста и других терапевтически важных генов, расщепляя их мРНК. Модифицируя субстрат-связывающую последовательность, можно получать рибозимы, специфичные к определенной мРНК. Рибозимы можно синтезировать непосредственно в клетке транскрипцией синтетического олигодезоксирибонуклеотида, кодирующего каталитический домен и фланкирующие его гибридизующиеся участки.

Рис. 3.23. Расщепление мРНК под действием рибозимов. Стрелкой показан сайт расщепления
Такой олигонуклеотид встраивают в эукариотический экспрессирующий вектор и помещают в клетку. Образующаяся РНК самопроизвольно приобретает активную конформацию, так называемую форму «головки молотка». Множество рибозимов различной структуры и активности синтезировано химически. Например, в лаборатории нуклеиновых кислот Института химической биологии и экспериментальной медицины СО РАН (Новосибирск) проводятся многолетние исследования по получению синтетических рибозимов, обладающих повышенной активностью и стабильностью.
Для повышения защиты от преждевременного расщепления внутриклеточными нуклеазами получают различные производные рибозимов - с метилированными 2"-гидроксильными (см. рис. 3.22, г) группами, бинарные конструкции и т.п. Строение молекулы рибозима существенным образом влияет на его эффективность. На рис. 3.24 показана кинетика расщепления мРНК гена множественной лекарственной устойчивости mdr1 с помощью синтезированных рибозимов разной структуры.

Рис. 3.24. Расщепление 190-звенного 5"-концевого фрагмента MDR1 мРНК модифицированными бинарными (1,3) и полноразмерными (2,4) рибозимами: а - структура РНК с выделенным специфическим сайтом; б - накопление продуктов расщепления (материалы предоставлены А.Г. Веньяминовой, ИБХиФМ, Новосибирск)
Особое место в молекулярной терапии занимают так называемые методы активирования пролекарств. Например, одним из способов генной терапии рака является уничтожение опухолевых клеток с помощью активированного производного ганцикловира (GCV, производное гуанозина), продукта гена тимидинкиназы, из уже упомянутого нами вируса простого герпеса HSVtk.
Опухолевые клетки трансфецируют in vivo геном HSVtk под активным промотором и через несколько дней вводят ганцикловир, который фосфорилируется вирусной тимидинкиназой до монофосфата, а затем киназами клетки-хозяина до трифосфата. Это производное ингибирует ДНК-полимеразу и останавливает синтез ДНК, что приводит к гибели пролифилирующих клеток. Через межклеточные контакты ганцикловиртрифосфат проникает в соседние немодифицированные клетки и таким образом уничтожается дополнительно до десятка опухолевых клеток.
Ген, приводящей к гибели собственной клетки, называется геном «самоубийства» (в нашем случае это ген тимидинкиназы), а термин «пролекарство» относится к неактивной форме лекарственного вещества (в данном случае это ганцикловир). Этот подход был использован и для создания других вариантов комбинации генактиватор-пролекарство, но эффективность системы GCV-HSVtk уже доказана рядом доклинических испытаний.
Генная терапия является новой лечебной дисциплиной, становление которой происходит на наших глазах. Несмотря на некоторые успехи и многообещающие перспективны, существует ряд проблем, которые еще предстоит преодолеть.
Часть проблем лежит далеко не в плоскости медицины и молекулярной биологии. Речь идет о проблемах этических и политических. Как вы уже заметили, мы рассматривали методы генетической терапии только соматических клеток. Это означает, что произведенные коррекции ограничиваются определенным органом или тканью, «исправленные» гены не будут передаваться следующему поколению. Изменения генотипа зародышевых клеток (сперматозоидов или яйцеклеток) или оплодотворенных клеток должны передаваться из поколения в поколение.
В настоящее время генная терапия соматических клеток отнесена к стандартным методам медицинского вмешательства. В противоположность этому генная терапия зародышевых клеток является технологически гораздо более сложной, проблематичной и непредсказуемой. Поэтому эксперименты в этой области во многих странах запрещены.
В конце 80-х гг. в США были установлены правила, регулирующие испытания в области генетической терапии соматических клеток. Они гарантируют беспристрастный и репрезентативный отбор больных и их информированность (насколько опасно лечение, какова вероятность его успеха и пр.), конфиденциальность сведений о больных и произведенных исследованиях, осуществление всех манипуляций должным образом без причинения вреда, как конкретным больным, так и человеческой популяции в целом.
Поскольку лечение соматических клеток приводит к улучшению состояния и значительному продлению жизни больных с генетическими заболеваниями, но «улучшенный» ген не передается по наследству, существует мнение, что это приведет к накапливанию генетических заболеваний в человеческой популяции. Однако, по данным популяционной генетики, для существенного повышения частоты вредного гена в результате эффективного лечения требуются тысячи лет.
Н.А. Воинов, Т.Г. Волова
В большинстве методов генной терапии ех vivo и in vivo используются клонированные генетические конструкции, возмещающие функциональную форму белка, который не синтезируется в организме больного или синтезируется в дефектной форме. Однако многие заболевания человека (рак, воспаления, вирусные и паразитарные инфекции) связаны, напротив, с гиперпродукцией нормального белка. Для лечения таких состояний разработаны терапевтические
системы с использованием специфических олигонуклеотидов. Такой небольшой олигонуклеотид может гибридизоваться со специфическим геном или мРНК и снижать уровень транскрипции или трансляции, уменьшая тем самым количество синтезируемого белка, ответственного за патологию. Олигонуклеотид, который гибридизуется с самим геном и блокирует его транскрипцию, называется «антигенным», а тот, который гибридизуется с соответствующей мРНК, - «антисмысловым» (Antisense RNA). Для предотвращения активации транскрипции специфических генов можно так-же использовать двухцепочечные олигонуклеотиды, специфично присоединяющиеся к ДНК-связывающим белкам (белкам-активаторам). Наконец, для уменьшения количества определенной мРНК и синтезируемого на ней белка можно использовать рибозимы - природные РНК-последовательности, которые связываются со специфическими молекулами РНК и разрезают их.
В будущем лекарственные средства на основе нуклеиновых кислот, по-видимому, найдут широкое применение, при этом главным объектом научных исследований и клинических испытаний будут различные «антисмысловые» олигонуклеотиды.
3.1..«Антисмысловые» олигонуклеотиды как лекарственные средства
«Антисмысловая» РНК (Antisense RNA), которую предполагается использовать в качестве лекарственного средства, представляет собой короткий (15-20-нуклеотидов) олигонуклеотид, который может связываться с комплементарным ей определенным участком мРНК и ингибировать трансляцию кодируемого ей белка, подавляя тем самым патологический процесс (рис.2).
Терапевтический эффект синтетических «антисмысловых» олигонуклео-тидов зависит от специфичности их гибридизации с доступным сайтом мРНК-мишени, устойчивости к действию клеточных нуклеаз и наличия системы доставки в клетку. 15-20-нуклеотидные последовательности гибридизуются с уникальными мРНК с достаточно высокой специфичностью. Потенциальные сайты-мишени определяют тестированием набора «антисмысловых» олигонуклеотидов с использованием культуры клеток, синтезирующих мРНК-мишень. Для этого проводят электрофоретическое разделение клеточных белков, в которые включают радиоактивную метку во время трансляции, и с помощью радиоавтографии устанавливают, в присутствии какого из «антисмысловых» олигонуклеотидов снижается синтез определенного белка. Никаких общих критериев выбора наилучших сайтов-мишеней в разных РНК-транскриптах не существует. Эффективными могут оказаться олигонуклеотиды, комплементарные 5"- или 3"-концам мРНК, границам экзонов и интронов и даже двухцепочечным областям. Антисмысловые олигонуклеотиды могут разрушаться внутриклеточными нуклеазами, поэтому важно защитить их от действия последних так, чтобы они не утратили способности к гибридизации с мишенью. Для этого можно модифицировать определенным образом пиримидиновые основания, рибозу или дезоксирибозу (рис.3). Так, у наиболее широко применяющихся сейчас «антисмысловых» олигонуклеотидов свободный атом кислорода фосфодиэфирной связи заменен на группу SH (рис. 3Б), в результате чего образуется тиофосфатная связь. Модифицированные таким образом олигонуклеотиды растворяются в воде, несут отрицательный заряд и не расщепляются под действием эндонуклеаз. При гибридизации с сайтом-мишенью они образуют дуплексы, которые активируют рибонуклеазу (РНКазу), эндогенный фермент, расщепляющий мРНК в такой гибридной молекуле. Проведены первые клинические испытания таких олигонуклеотидов - лекарственных средств «первого поколения». Мишенями являются РНК цитомегаловируса, вируса иммунодефицита человека, а также мРНК генов, ответственных за развитие рака, болезней кишечника и других заболеваний.
Синтезированы «антисмысловые» олигонуклеотиды с фосфорамидитной и полиамидной (пептидной) связями - пептидные нуклеиновые кислоты (Peptide nucleicacids, PNAs) (рис.3В и Г ). Такие молекулы очень устойчивы к действию нуклеаз. Химические группы, присоединенные к 2"-углеродному атому сахарного остатка и С-5-атому пиримидинов, также защищают «антисмысловые» олигонуклеотиды и облегчают их связывание с сайтом-мишенью (рис. 32Д и Е ). Все преимущества этих и других модификаций сейчас интенсивно изучаются.
Проникновение «антисмыловых» олигонуклеотидов в клетку можно значительно облегчить, поместив их в липосомы. Такая высокоэффективная система доставки позволяет использовать «антисмысловые» олигонуклеотиды в небольших концентрациях. Если же конъюгировать липосомы с антителами, специфичными к эпитопам определенных клеток тех или иных органов, то можно будет осуществлять адресную доставку «антисмысловых» олигонуклеотидов.
Проведенные доклинические испытания оказали, что «антисмысловые» олигонуклеотиды являются весьма эффективными лекартвенными средствами. Изучена возможность их применения для лечения стеноза коронарых и сонных артерий, который приводит к инфарктам и инсультам. В этих случаях часто прибегают к ангиопластике, расширению артерий с помощью баллонного катетера, но примерно у 40% больных через 6 месяцев вновь возникают стенозы, поскольку ангиопластика стимулирует пролиферацию гладкомышечных клеток и секрецию межклеточного вещества во внутренний слой артерии в месте ее расширения. В одном из экспериментов в сонные артерии крыс после ангиопластики вводили антисмысловые» олигонуклеотиды с тиофосфатными связями, комплементарные мРНК, которые кодируют важные для клеточного циклa млекопитающих белки; в результате частота повторных стенозов уменьшилась на 90%. Пролиферация гладкомышечных клеток происходит также при атеросклерозе, сахарном диабете, осложнениях после коронарного шунтирования. Вероятно, все эти состояния можно будет контролировать аналогичными способами.

«Антисмыловые» олигонуклеотиды можно применять и для лечения вирусных инфекций и малярии. Кроме того, результаты I фазы клинических испытаний лечения болезни Крона с помощью орального введения «антисмыслового» олигонуклеотида проиллюстрировали четко выраженный терапевтический эффект без заметных побочных эффектов. В этом случае мРНК-мишень кодировала межклеточный адгезии типа 1, который вырабатывается в избытке у пациентов с болезнью Крона. Предполагается исследовать эффективность этого же олигонуклеотида для терапии других воспалительных заболеваний, например ревматоидного артрита, псориаза и язвенного колита.
В принципе «антисмысловые» олигонуклеотиды могут образовывать тройную спираль с хромосомной ДНК-мишенью и блокировать транскрипцию. Однако пока специфичность «антигенных» олигонуклеотидов не соответствует стандартам, принятым для лекарственных средств.
04.07.2013 - 31.12.2013
Проведен систематический анализ современной литературы по теме исследования. Установлены последовательности наиболее перспективных, с точки зрения исполнителей проекта, производных олигонуклеотидов и их аналогов, которые должны проявлять противовирусную и антибактериальную активности.
Разработаны методики синтеза модифицированных олигонуклеотидов и их конъюгатов с использованием автоматических ДНК/РНК-синтезаторов или в режиме неавтоматизированного синтеза на твердотельном носителе. Для дизайна олигонуклеотидных производных с заданной функциональностью предложены различные подходы, в том числе, основанные на прогностическом анализе структуры и стабильности формируемых дуплексов с помощью метода молекулярной динамики. Предложен способ синтеза новых, ранее не описанных производных олигонуклеотидов, несущих модификации по атому фосфора межнуклеотидной фосфодиэфирной группировки.
Разработана методика анализа эффективности проникновения флуоресцеин-меченных соединений в бактериальные клетки. Показано, что положительно заряженные производные пептида Flu-(LR)4G-амида эффективно проникают и накапливаются в Pseudomonas aeruginosa, а эффективность проникновения в нее олигонуклеотидов без транспортного пептида низка.
Все разработанные при выполнении исследований методики, как синтетические, так и аналитические, внедрены в работу Лаборатории Биомедицинской Химии ИХБФМ СО РАН. Полученные теоретические наработки использованы в образовательных курсах.
Созданная в лаборатории синтетическая база для получения, выделения и характеризации олигонуклеотидов является уникальной для РФ и близка к уровню лучших мировых научно-исследовательских лабораторий соответствующей специализации. Привлечение специалистов биологического профиля делает лабораторию уникальной по потенциалу ее научно-исследовательской реализации в направлении разработки РНК-направленных противовирусных и антибактериальных препаратов.
Развернуть
01.01.2014 - 31.12.2014
i) Оценка антибактериальной активности аналогов олигонуклеотидов/олигонуклеотидных конъюгатов по отношению к Pseudomonas aeruginosa, Salmonella typhimurium; Staphylococcus aureus;
ii) Оценка антивирусной активности аналогов олигонуклеотидов/олигонуклеотидных конъюгатов по отношению к вируса гриппа WSN33/A/H1N1.
iii) Выбор последовательностей олигонуклеотидных аналогов- лидеров, проявляющих антибактериальную или противовирусную активность на требуемом уровне;
iv) Разработка протоколов синтеза олигонуклеотидных конъюгатов, содержащих группы, которые увеличивают эффективность их накопления в эукариотических или бактериальных клетках
iv) Оценка эффективности проникновения и накопления разработанных соединений в бактериальных и эукариотических клетках.
v) Подготовленная лаборатория;
vi) Статьи в научной периодике, индексируемой в Web of Science.
vii) Тезисы докладов на конференциях;
viii) Свидетельства об участии в в образовательных курсах;
ix) Конференция;
Развернуть
01.01.2015 - 31.12.2015
3.1 Антибактериальная активность соединений, содержащих последовательности-лидеры по отношению к Pseudomonas aeruginosa, Salmonella typhimurium; Staphylococcus aureus in vitro (в клеточной культуре);
3.2 Противовирусная активность соединений, содержащих последовательности-лидеры, по отношению к вирусу гриппа in vitro;
3.3. Технологические и терапевтические характеристики отобранных олигонуклеотидных аналогов и конъюгатов с учетом путей коммерциализации препаратов, в том числе:
3.3.1 Список стандартизованных экспериментальных методик для оценки антибактериальной и противовирусной активности препаратов олигонуклеотидных аналогов in vitro (в культуре клеток) и in vivo (на животных моделях);
3.3.3 Отобранные олигонуклеотидные аналоги и конъюгаты, которые наряду с проявлением высокой антибактериальной и противовирусной активности способны к эффективному проникновению и накоплению в клетках, в том числе:
3.3.2.1 Данные по проникновению в клетки и доставки модифицированных олигонуклеотидных аналогов и конъюгатов;
3.3.2.2 Оптимизированный полупрепаративный синтез, пре- и пост-синтетические модификации, выделение и количественный контроль олигонуклеотидных аналогов, проявляющих антибактериальную и противовирусную активность;
3.3.2.3. Оценка разработанных соединений с антибактериальной и противовирусной активностью с точки зрения коммерческого использования.
3.4 Подготовленный финальный отчет по Проекту;
3.5 Подготовленная лаборатория;
3.6 Тезисы докладов на конференциях;
3.7 Свидетельства об участии в в образовательных курсах;
3.8 3статьи в научной периодике, индексируемой в Web of Science
Председатели: Т.В. Овчинникова, Н.Ф. Мясоедов
Заседание 1
Председатели: Н.Ф. Мясоедов, Т.В. Овчинникова
Большой зал
19 сентября, 9:30 - 11:30
25 мин Н.Ф. Мясоедов
Лекарственные средства на основе пептидов
20 мин С.А. Лимборская Институт молекулярной генетики РАН, Москва, Россия
Молекулярно-генетические механизмы пептидной регуляции
15 мин Р.У. Островская
Ноопепт - новые механизмы действия и перспективы применения
15 мин Т.Н. Соллертинская 1 , М.В. Шорохов 1 , Н.Ф. Мясоедов 2 , Л.А. Андреева 2 1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН, Санкт-Петербург; 2 Институт молекулярной генетики РАН, Москва, Россия
Особенности нейропептидной коррекции когнитивных и психо-эмоциональных нарушений при синдроме хронической усталости у млекопитающих (эволюционные аспекты исследования)
15 мин И.И. Бобынцев , О.И. Сороколетова, А.Е. Белых Курский государственный медицинский университет, Курск, Россия
Исследование анксиолитических и анальгетических эффектов пептида Gly-His-Lys (GHK) и его структурных аналогов
Заседание 2
Председатели: С.Н. Кочетков, Т.В. Овчинникова
Большой зал
19 сентября, 16:00 - 18:00
25 мин С.Н. Кочетков
Новые ингибиторы развития социально-значимых инфекций
20 мин Т.В. Овчинникова Институт биоорганической химии им. М.М.
Терапевтический потенциал антимикробных пептидов
15 мин В.Н. Кокряков 1,2 , О.В. Шамова 1,2 , Г.М. Алешина 1 , М.Н. Берлов 1,2 , Т.В. Овчинникова 3 1 Институт экспериментальной медицины, Санкт-Петербург; 2 Санкт-Петербургский государственный университет, Санкт-Петербург; 3 Институт биоорганической химии им.
Достижения отечественной школы биохимиков в изучении структуры и функций антибиотических пептидов животного происхождения
15 мин О.В. Шамова 1 , 2 , М.С. Жаркова 1 , П.М. Копейкин 1 , Т.А. Лукьянова 1 , А.Ю. Артамонов 1 , С.В. Баландин 3 , Т.А. Филатенкова 1 , А.С. Назаров 1,2 , К.Э. Сафиуллина 1 , М.С. Сухарева 1 , Т.Ю. Пазина 1 , Т.М. Гринчук 4 , В.Н. Кокряков 1,2 , Т.В. Овчинникова 3 , Д.С. Орлов 1,2 1 Институт экспериментальной медицины», Санкт-Петербург; 2 Санкт-Петербургский государственный университет, Санкт-Петербург; 3 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва; 4 Институт цитологии РАН, Санкт-Петербург, Россия
Пролин-богатые пептиды врожденного иммунитета как прототипы новых антимикробных и противоопухолевых лекарственных препаратов
15 мин И.Е. Елисеев 1 , И.Н. Тертеров 1 , О.В. Шамова 2 , М.В. Дубина 1 1 Санкт-Петербургский академический университет; 2 Институт экспериментальной медицины, Санкт-Петербург, Россия
Использование паттернов аминокислотных последовательностей для дизайна альфа-спиральных антимикробных пептидов
15 мин М.Н. Берлов 1,2 , Е.С. Умнякова 1 , А.В. Соколов 1 , Т.В. Овчинникова 3 , В.Н. Кокряков 1,2 1 Институт экспериментальной медицины, Санкт-Петербург; 2 Санкт-Петербургский государственный университет, Санкт-Петербург; 3 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия
Взаимодействие катионных антимикробных пептидов с белком C1q и их влияние на активацию комплемента
Заседание 3
Председатели: Н.Ф. Мясоедов, Л.П. Овчинников
Большой зал
20 сентября, 9:30 - 11:30
25 мин Л.П. Овчинников 1 , Н.В. Бобкова 2 1 Институт белка РАН, Пущино; 2 Институт биофизики клетки РАН, Пущино, Россия
Разработка инновационного лекарственного средства против болезни Альцгеймера на основе белка YB-1
20 мин О.М. Вольпина 1 , Д.О. Короев 1 , Т.Д. Волкова 1 , А.В. Камынина 1 , М.П. Филатова 1 , С.М. Баласанянц 1 , Н.И. Медвинская 2 , П.В. Некрасов 2 , И.В. Нестерова 2 , А.Н. Самохин 2 , Н.В. Бобкова 2 1 М.М. Шемякина и Ю.А. Овчинникова РАН, Москва; 2 Институт биофизики клетки РАН, Пущино Московской области, Россия
Протективная активность пептидов в нейродегенеративных процессах альцгеймеровского типа
15 мин А.В. Таллерова НИИ фармакологии им. В.В. Закусова, Москва, Россия
Дипептидный миметик мозгового нейротрофического фактора ГСБ-106 - перспективный антидепрессант нового поколения
15 мин К.Н. Колясникова , Т.А. Гудашева, С.Б. Середенин НИИ фармакологии им. В.В. Закусова, Москва, Россия
Замещенный глипролин ГЗК-111 - новый дипептид с анксиолитической и нейропротекторной активностями
15 мин А.В. Аветисян 1 , Р.А. Зиновкин 1 , Р.А. Симонян 1 , П.В. Некрасов 2 , А.Н. Самохин 2 , Д.О. Короев 3 , О.М. Вольпина 3 , Н.В. Бобкова 2 1 НИИ физико-химической биологии им. А.Н. Белозерского МГУ, Москва; 2 Институт биофизики клетки РАН, Пущино; 3 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия
Синтетические пептиды к внеклеточному домену RAGE восстанавливают митохондрии в мозге бульбэктомированных мышей
15 мин А.Д. Слободина 1,2 , О.И. Большакова 1 , А.Л. Шварцман 1 , С.В. Саранцева 1 1 Национальный исследовательский центр «Курчатовский институт», Петербургский институт ядерной физики им. Б.П. Константинова, Гатчина; 2 Санкт-Петербургский политехнический университет Петра Великого, Санкт-Петербург, Россия
Комбинированные пептиды как перспективные соединения для терапии болезни Альцгеймера
Заседание 4
Председатель: Е.Д. Свердлов
Большой зал
20 сентября, 16:50 - 18:50
15 мин В.А. Митькевич , А.А. Макаров Институт молекулярной биологии им. В.А. Энгельгардта РАН, Москва, Россия
Разработка противоопухолевого средства на основе рибонуклеазы биназы
15 мин А.В. Степанов 1,2 , А.А. Белогуров 1,2 , А.Г. Габибов 1,2 1 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва; 2 Казанский (Приволжский) федеральный университет, Казань, Россия
Применение химерных антигенных рецепторов Т-клеток слитных с лигандом В‑клеточного рецептора для терапии неходжкинских лимфом
15 мин В.А. Рихтер 1 , Е.В. Кулигина 1 , О.В. Коваль 1 , Г.В. Кочнева 2 , А.А. Немудрая 1 , А.А. Макарцова 1 , О.С. Троицкая 1 1 Институт химической биологии и фундаментальной медицины СО РАН, Новосибирск, Россия 2 Государственный научный центр вирусологии и биотехнологии, Кольцово, Новосибирская обл., Россия
Способы повышения противоопухолевой эффективности Лактаптина
15 мин А.А. Розенкранц, Т.А. Сластникова, А.В. Уласов, А.С. Соболев Институт биологии гена РАН; Московский государственный университет им. М.В. Ломоносова, Москва, Россия
Направленная внутриклеточная доставка противораковых агентов с помощью модульных нанотранспортеров
15 мин И.В. Алексеенко Институт молекулярной генетики РАН; Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия
Проблемы и перспективы генно-терапевтических препаратов для лечения рака
15 мин Д.В. Сверчинский , В.Ф. Лазарев, И.В. Гужова, Б.А. Маргулис Институт цитологии РАН, Санкт-Петербург, Россия
Модуляторы активности шаперона Hsp70 и их противоопухолевый потенциал
15 мин С.С. Ларин , М.И. Лукашина, А.В. Кибардин, А.В. Посвятенко, Е.Ю. Лысюк, Г.П. Георгиев Институт биологии гена РАН, Москва, Россия
Мембраносвязанные и растворимые формы стресс-индуцированных MHC подобных молекул как перспективные маркёры в диагностике и терапии злокачественных опухолей
Заседание 5
Председатели: Н.Ф. Мясоедов, В.А. Стоник
Большой зал
21 сентября, 9.30 - 11.30
25 мин В.А. Стоник Тихоокеанский институт биоорганической химии им. Г.В.Елякова Дальневосточного отделения Российской академии наук, Владивосток, Россия
От исследований морских природных соединений к новым идеям и биопрепаратам
20 мин П.В. Сергиев 1,2 , И.А. Остерман 1,2 , Е.С. Комарова 1,2 , А.А. Богданов 1 , О.А. Донцова 1,2 1 Московский государственный университет им. М.В. Ломоносова, 2 Сколковский институт науки и технологий, Москва, Россия
Поиск новых антибиотиков и изучение механизма их действия
15 мин Я.Р. Паникратова 1 , И.С. Лебедева 1 , О.Ю. Соколов 1 , Д.А. Куприянов 2 , А.Д. Румшиская 3 , Н.В. Кост 1 , Н.Ф.Мясоедов 1 1 ФГБНУ НЦПЗ; ‑ 2 ОО Филипс; 3 ФГАУ «ЛРЦ» МЗ РФ, Москва, Россия
Изучение влияния Семакса на активность нейрональных сетей головного мозга человека методом функциональной магнито-резонансной томографии (фМРТ)
15 мин Е.Ф. Колесанова , Е.А. Егорова, В.Н. Прозоровский, О.М. Ипатова НИИ биомедицинской химии им. В.Н. Ореховича, Москва, Россия
Синтетические пептиды в инновационных лекарственных препаратах: пептидные иммуногены и пептиды-транспортеры
15 мин Б.П. Челобанов 1,2 , А.А. Фокина 1 , А.М. Ильина 2 , К.В. Клабенкова 2 , Е.А. Буракова 1 , M. Фуджии 3 , Д.А. Стеценко 1,2 1 Институт химической биологии и фундаментальной медицины СО РАН, Новосибирск; 2 Новосибирский государственный университет, Новосибирск, Россия; 3 Университет Киндай, Фукуока, Япония
Пептидные конъюгаты аналогов олигонуклеотидов как потенциальные терапевтические агенты
15 мин А.А. Замятнин (мл.) 1,2 , А.В. Балакирева 1 , Н.В. Гороховец 1 , Е.Ю. Зерний 2 , Н.В. Кузнецова 1 , В.А. Макаров 1 , А.И. Петушкова 3 , Л.В. Савватеева 1 1 Институт молекулярной медицины, Первый МГМУ им. И.М. Сеченова, Москва; НИИ Физико-химической биологии им. А.Н. Белозерского МГУ, Москва; 3 Биологический факультет, МГУ им. М.В. Ломоносова, Москва, Россия
Создание энзиматического средства для эффективной детоксификции глютена
Заседание 6
Председатели: В.М. Липкин, Т.В. Овчинникова
Большой зал
21 сентября, 16.15 - 18.15
15 мин И.А. Гривенников 1 , Е.В. Новосадова 1 , С.А. Антонов 1 , Е.С. Мануилова 1 , Е.Л. Арсеньева 1 , М.А. Грефенштейн 1 , А.М.Зыкова 1 , Кобылянский А.Г. 1 , В.В. Симонова 3 , Л.Г. Хаспеков 3 , О.С. Лебедева 2 , М.А. Лагарькова 2 , С.Н.Иллариошкин 3 , В.З. Тарантул 1 ,Н.Ф. Мясоедов 1 1 Институт молекулярной генетики РАН; 2 ФНКЦ физико-химической медицины ФМБА России; 3 Научный центр неврологии РАМН, Москва
Тест-система на основе индуцированных плюрипотентных стволовых клеток человека
15 мин Е.В. Новосадова , Е.Л. Арсеньева, Е.С. Мануилова, М.А. Грефенштейн, Н.Ф. Мясоедов, И.А. Гривенников Институт молекулярной генетики РАН, Москва, Россия
Пептиды семейства меланокортинов способны модулировать экспрессию нейронспецифичных генов в процессе нейрональной дифференцировки индуцированных плюрипотентных стволовых клеток человека
15 мин А.П. Богачук 1 , З.И. Сторожева 2 , Ю.А. Золотарев 3 , Г.И. Ковалев 4 , В.Н. Азев 5 , А.Н. Мурашев 5 , Д.И. Ржевский 5 , Г.Б. Телегин 5 , В.М. Липкин 1 1 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН; 2 Федеральный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского; 3 Институт молекулярной генетики РАН; 4 НИИ фармакологии РАН, Москва, Россия; 5 Филиал Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Пущино Московской области, Россия
Доклинические исследования нового нейропротекторного лекарственного средства на основе пептида
15 мин Ю.А. Золотарев 1 , Г.И. Ковалёв 2 , Н.В. Кост 3 , О.Ю. Соколов 3 , А.К. Дадаян 1 , В.С. Козик 1 , С.И. Шрам 1 , Е.В. Васильева 2 , А.П. Богачук 4 , В.М. Липкин 4 , Н.Ф. Мясоедов 1 1 Институт молекулярной генетики РАН; 2 НИИ фармакологии им. В.В. Закусова; 3 Научный центр психического здоровья; 4 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия
Анксиолитическая и нейропротекторная активность регуляторного пептида HLDF-6 на моделях болезни Паркинсона и тревожных расстройств
15 мин А.К. Дадаян 1 , Ю.А. Золотарев 1 , В.С. Козик 1 , С.И. Шрам 1 , И.Ю. Нагаев 1 , В.Н. Азев 2 , А.П. Богачук 3 , В.М. Липкин 3 , Н.Ф. Мясоедов 1 1 Институт молекулярной генетики РАН, Москва; 2 Филиал Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Пущино; 3 Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, Россия
Фармакокинетика ацетамидной формы пептида HLDF-6 в тканях лабораторных животных с использованием меченных тритием и дейтерием производных.
Перспективным направлением является развитие генных технологий.
1. Они способны существенно оптимизировать традиционную фармакотерапию (фармакогеномика).
2. Особые надежды возлагаются на генно-инженерные разработки препаратов для защиты от инфекционных болезней и патогенов.
Еще одно направление - биотехнологические препараты. Начинается конкуренция между традиционными синтетическими лекарственными средствами и биофармацевтическими препаратами. Становится привычным новый термин «биофармация».
В 2006 году объем мирового фармарынка составлял примерно 640 млрд. долл., при этом 10% уже приходилось на долю биотехнологических продуктов. Лидерами в области биофармации являются США и Германия.
Разработке современных биофармацевтических препаратов предшествовало освоение других биотехнологических методов, в частности ферментации бактерий и грибов, что позволило развить промышленное производство низкомолекулярных лекарственных средств, например антибиотиков, ингибиторов ГМГ-КоА-редуктазы (гидрокси-метилглутарил-коферментаА-редуктаза) и иммуносупрессоров. Биотехнологические лекарственные средства - это лекарственные препараты, предназначенные для профилактики, лечения или диагностики in vivo, которые развивают не фармакологическую, а биологическую активность. Они обладают рядом существенных отличий от химико-синтетических лекарственных средств. Действующее вещество биотехнологических препаратов имеет биологическое происхождение и является производным от живых клеток, обладает сложной гетерогенной молекулярной структурой. Исходным субстратом служат клетки животного происхождения или микроорганизмы (бактерии типа E.coli, дрожжи и пр.), используются их клеточные и субклеточные структуры.
Существенным отличием биотехнологических лекарственных средств является то, что в них используется естественная способность к метаболизму.
Для их получения производится изоляция и изменение геномной ДНК исходного продукта таким образом, что он получает новую, неспецифическую для данного вида способность к биосинтезу, которая и используется в лекарственных средствах. В первую очередь здесь следует назвать создание генномодифицированных организмов для получения рекомбинантных терапевтических протеинов. В настоящее время уже используется 115 лекарственных средств на основе 84 терапевтических протеинов. В 2006 г. в США в разработке находилось 418 биофармацевтических лекарственных средств, в Европе - 320. Часть из них уже проходят клинические исследования и скоро станут доступными врачам и их пациентам. По оптимистическим прогнозам, в 2015 г. половина инновационных лекарственных средств в мире будут основаны на протеинах или олигонуклеотидах. Следует также ожидать выхода на фармрынок новой категории лекарственных средств - биосимиляров - аналогов оригинальных биотехнологических лекарственных средств со сходной, но неидентичной активной молекулой. В ЕС в этом году зарегистрированы два первых биосимиляра (гормона роста - соматотропина). На регистрации в European Medicines Agency находятся порядка 12 биосимиляров (эритропоэтин и др.). Ожидается, что введение в медицинскую практику биосимиляров резко снизит затраты здравоохранения на биотехнологические лекарственные средства, сделает их доступными для широких слоев населения. В руках у врачей окажутся еще более эффективные препараты для борьбы с серьезными заболеваниями, многие из которых раньше считались неизлечимыми.