Конечный продукт распада пиримидиновых нуклеотидов. Распад нуклеиновых кислот
Читайте также
Распад пуриновых нуклеотидов.
Аденозин и гуанозин, которые образуются при гидролизе пуриновых нуклеотидов, подвергаются ферментативному распаду с образованием конечного продукта – мочевой кислоты, которая выводится с мочой из организма.
Распад пиримидиновых нуклеотидов.
Начальные этапы этого процесса катализируются специфическими ферментами. Конечные продукты: СО 2 , NН 3 , мочевина, β-аланин, β-аминоизомасляная кислота. β-аланин используется для синтеза дипептидов мышц – карнозина и ансерина или выделяется с мочой.

Биосинтез пуриновых, пиримидиновых нуклеотидов в тканях.
Биосинтез пуриновых мононуклеотидов.
Первоначальным соединением синтеза служит Д-рибозо-5-фосфат, который является продуктом пентозофосфатного цикла и на который переносится пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (ФРПФ) взаимодействует с глутамином, который является донором NН 2 -группы в результате чего образуется β-5-фосфорибозил-амин. Эта стадия становится ключевой в синтезе пуринов. Затем присоединяется молекула глицина к свободной NН2-группе β-5-фосфорибозил-амина с образованием глицинамидрибонуклеотида. Еще через несколько стадий образуется первый пуриновый нуклеотид инозинмонофосфат (ИМФ), из которого затем синтезируются остальные нуклеозидфосфаты.

Биосинтез пиримидиновых нуклеотидов
Первоначальными соединениями этого процесса являются карбамоилфосфат и аспарагиновая кислота. Из них через длинную цепь реакций образуется уридинмонофосфат (УМФ) и остальные пиримидиновые нуклеотиды.

2.4. Заболевания, связанные с нарушением обмена нуклеотидов: подагра, синдром Леша-Нихена.
Гиперурикемия – повышение в плазме крови концентрации мочевой кислоты. Вследствие гиперурикемии может развиться подагра.
Подагра – заболевание, вызванное нарушением обмена нуклеиновых кислот. В хрящах, сухожилиях, в суставных сумках, иногда в почках, коже, мышцах откладываются кристаллы мочевой кислоты и уратов. Вокруг этих отложений образуется воспаление и грануляционный вал, который окружает омертвевшую ткань, при этом образуются подагрические узлы - тофусы (в суставах пальцев рук, ног, в хрящах ушной раковины), что сопровождается деформацией и болезненностью пораженных суставов. К характерным признакам подагры относятся повторяющиеся приступы острого воспаления суставов (чаще всего мелких) – острого подагрического артрита. Обычно больные склонны к атеросклерозу и гипертонии. В их крови наблюдается большая концентрация мочевой кислоты – гиперурикемия. В течение нескольких дней перед приступом подагры увеличивается выделение воды и хлорида натрия с мочой, т.е. сдвигается водно-солевой баланс. Вследствие этого возрастает концентрация мочевой кислоты в крови и отложение ее в тканях. Как правило, подагра генетически детерминирована и носит семейный характер. Она вызвана нарушениями в работе фосфорибозилдифосфата (ФРДФ) синтетазы или гипоксантингуанин- или аденинфосфорибозилтрансфераз. К другим характерным проявлениям относят нефропатию, при которой наблюдают образование уратных камней в мочевыводящих путях.
Синдром Леша-Нихена – тяжелая форма гиперурикемии, которая наследуется как рецессивный признак, сцепленный с Х-хромосомой. Проявляется только у мальчиков. Кроме симптомов подагры наблюдаются церебральные параличи, нарушение интеллекта, попытки наносить себе раны (укусы губ, пальцев). Связана болезнь с дефектом фермента гипоксантин-гуанин-фосфорибозилтрансферазы, которая катализирует превращение гипоксантина и гуанина в гуанинимонофосфат (ГМФ), поэтому они превращаются в мочевую кислоту. В первые месяцы жизни неврологические расстройства не обнаруживаются, но на пеленках отмечают розовые пятна, вызванные присутствием в моче кристаллов мочевой кислоты. При отсутствии лечения больные погибают в возрасте до 10 лет из-за нарушения функции почек.
Основной препарат для лечения гиперурикемии – аллопуринол (структурный аналог гипоксантина).
Б. "Запасные" пути синтеза пиримидиновых нуклеотидов
Использование пиримидиновых оснований и нуклеозидов в реакциях реутилизации препятствует катаболизму этих соединений до конечных продуктов с расщеплением пиримидинового кольца. В ресинтезе пиримидинов участвуют некоторые ферменты катаболизма нуклеотидов. Так, уридинфосфорилаза в обратимой реакции может рибозилироватъ урацил с образованием уридина.
Урацил + Рибозо-1-фосфат → Уридин + Н 3 РО 4 .
Превращение нуклеозидов в нуклеотиды катализирует уридин-цитидинкиназа.
Часть ЦМФ может превращаться в УМФ под действием цитидиндезаминазы и пополнять запасы уридиловых нуклеотидов.
ЦМФ + Н 2 О → УМФ + NH 3 .
В. Регуляция синтеза пиримидиновых НУКЛЕОТИДОВ
Регуляторным ферментом в синтезе пиримидиновых нуклеотидов является полифункциональныйКАД-фермент. УМФ и пуриновые нуклеотиды аллостерически ингибируют, а ФРДФ активирует его карбамоилсинтетазную активность, тогда как активность аспартаттранскарбамоилазного домена ингибирует ЦТФ, но активирует АТФ (рис. 10-15).
Этот способ регуляции позволяет предотвратить избыточный синтез не только УМФ, но и всех других пиримидиновых нуклеотидов и обеспечить сбалансированное образование всех четырёх основных пуриновых и пиримидиновых нуклеотидов, необходимых для синтеза РНК.
Оротацидурия
Это единственное нарушение синтеза пиримидинов de novo. Оно вызвано снижением активности УМФ-синтазы, которая катализирует образование и декарбоксилирование ОМФ. Поскольку в эмбриогенезе от образования пиримидинов de novo зависит обеспечение синтеза ДНК субстратами, то жизнь плода невозможна при полном отсутствии активности этого фермента. Действительно, у всех пациентов с оротацидурией отмечают заметную, хотя и очень низкую активность УМФ-синтазы. Установлено, что содержание оротовои кислоты в моче пациентов (1 г/сут и более) значительно превосходит количество оротата, которое ежедневно синтезируется в норме (около 600 мг/сут). Снижение синтеза пиримидиновых нуклеотидов, наблюдающееся при этой патологии, нарушает регуляцию КАД-фермента по механизму ретроингибирования, из-за чего возникает гиперпродукция оротата.
Клинически наиболее характерное следствие оротацидурии - мегалобластная анемия, вызванная неспособностью организма обеспечить нормальную скорость деления клеток эритроцитарного ряда. Её диагностируют у детей на том основании, что она не поддаётся лечению препаратами фолиевой кислоты.
Недостаточность синтеза пиримидиновых нуклеотидов сказывается на интеллектуальном развитии, двигательной способности и сопровождается нарушениями работы сердца и ЖКТ. Нарушается формирование иммунной системы, и наблюдается повышенная чувствительность к различным инфекциям.
Гиперэкскреция оротовои кислоты сопровождается нарушениями со стороны мочевыводя-щей системы и образованием камней. При отсутствии лечения больные обычно погибают в первые годы жизни. При этом оротовая кислота не оказывает токсического эффекта. Многочисленные нарушения в работе разных систем организма вызваны "пиримидиновым голодом".
Для лечения этой болезни применяют уридин (от 0,5 до 1 г/сут), который по "запасному" пути превращается в УМФ.
Уридин + АТФ → УМФ + АДФ.
Нагрузка уридином устраняет "пиримидиновый голод", а поскольку из УМФ могут синтезироваться все остальные нуклеотиды пиримидинового ряда, то снижается выделение оротовои кислоты из-за восстановления механизма ретроингибирования КАД-фермента. Для больных оротацидурией лечение уридином продолжается в течение всей жизни, и этот нуклеозид становится для них незаменимым пищевым фактором.
Кроме генетически обусловленных причин, оротацидурия может наблюдаться:
при гипераммониемии, вызванной дефектом любого из ферментов орнитинового цикла,
за исключением карбамоилфосфат- синтетазы I. В этом случае карбамоилфосфат, синтезированный в митохондриях, выходит в цитозоль клеток и начинает использоваться на образование пиримидиновых нуклеотидов. Концентрация всех метаболитов, в том числе и оротовой кислоты, повышается. Наиболее значительная экскреция оротата отмечается при недостаточности орнитинкарбамоилтрансферазы (второго фермента орнитинового цикла);
в процессе лечения подагры аллопуринолом, который превращается в оксипуринолмононуклеотид и становится сильным ингибитором УМФ-синтазы. Это приводит к накоплению оротовой кислоты в тканях и крови.
3. Инсулин-строение, синтез и секреция. Регуляция синтеза и секреции инсулина. Механизм действия инсулина. Роль инсулина и контринсулярных гормонов (адреналина и глюкагона) в регуляции метаболизма. Изменение гормонального статуса и метаболизма при сахарном диабете. Диабетическая кома.
Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками (рис. 1). Инсулин может существовать в нескольких формах: мономера, димера и гексамера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц.
Молекула инсулина содержит также внутримолекулярный дисульфидный мостик, соединяющий шестой и одиннадцатый остатки в А-цепи. Инсулины некоторых животных имеют значительное сходство по первичной структуре с инсулином человека.
В обеих цепях во многих положениях встречаются замены, не оказывающие влияния на биологическую активность гормона. Наиболее часто эти замены обнаруживаются в положениях 8, 9 и 10 цепи А.
В то же время в положениях дисульфидных связей, остатков гидрофобных аминокислот в С-концевых участках В-цепи и С- и N-концевых остатков А-цепи замены встречаются очень редко, что свидетельствует о важности этих участков для проявления биологической активности инсулина. Использование химических модификаций и замен аминокислот в этих участках позволили установить структуру активного центра инсулина, в формировании которого принимают участие остатки фенилаланина В-цепи в положениях 24 и 25 и N- и С-концевые остатки цепи А.
Биосинтез инсулина включает образование двух неактивных предшественников, препроинсулина и проинсулина, которые в результате последовательного протеолиза превращаются в активный гормон. Биосинтез препроинсулина начинается с образования сигнального пептида на полирибосомах, связанных с ЭР. Сигнальный пептид проникает в просвет ЭР и направляет поступление в просвет ЭР растущей полипептидной цепи. После окончания синтеза препроинсулина сигнальный пептид, включающий 24 аминокислотных остатка, отщепляется (рис. 2).
Рис.1. Структура инсулина человека. А. Первичная структура инсулина. Б. Модель третичной структуры инсулина (мономер): 1 - А-цепь; 2 - В-цепь; 3 - участок связывания с рецептором.
Проинсулин (86 аминокислотных остатков) поступает в аппарат Гольджи, где под действием специфических протеаз расщепляется в нескольких участках с образованием инсулина (51 аминокислотный остаток) и С-пептида, состоящего из 31 аминокислотного остатка.
Инсулин и С-пептид в эквимолярных количествах включаются в секреторные гранулы. В гранулах инсулин соединяется с цинком, образуя димеры и гексамеры. Зрелые гранулы сливаются с плазматической мембраной, и инсулин и С-пептид секретируются во внеклеточную жидкость в результате экзоцитоза. После секреции в кровь олигомеры инсулина распадаются. Т 1/2 инсулина в плазме крови составляет 3-10 мин, С-пептида - около 30 мин. Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках.
Регуляция синтеза и секреции инсулина. Глюкоза - главный регулятор секреции инсулина, а β-клетки - наиболее важные глюкозо-чувствительные клетки в организме. Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Действие глюкозы на скорость экспрессии генов может быть прямым, когда глюкоза непосредственно взаимодействует с транскрипционными факторами, или вторичным, через влияние на секрецию инсулина и глюкагона. При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, что сопровождается активацией транскрипции мРНК инсулина.

Рис. 2. Схема биосинтеза инсулина в β-клетках островков Лангерханса. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида; 2 - синтез препроинсулина; 3 - отщепление сигнального пептида; 4 - транспорт проинсулина в аппарат Гольджи; 5 - превращение проинсулина в инсулин и С-пептид и включение инсулина и С-пептида в секреторные гранулы; 6 - секреция инсулина и С-пептида.
Синтез и секреция инсулина не являются строго сопряжёнными процессами. Синтез гормона стимулируется глюкозой, а секреция его является Са 2+ -зависимым процессом и при дефиците Са 2+ снижается даже в условиях высокой концентрации глюкозы, которая стимулирует синтез инсулина.
Потребление глюкозы β-клетками происходит в основном при участии ГЛЮТ-1 и ГЛЮТ-2, и концентрация глюкозы в клетках быстро уравнивается с концентрацией глюкозы в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой, имеющей высокую К m , вследствие чего скорость её фосфорилирования почти линейно зависит от концентрации глюкозы в крови. Фермент глюкокиназа - один из важнейших компонентов глюкозо-чувствительного аппарата β-клеток, в который, помимо глюкозы, вероятно, входят промежуточные продукты метаболизма глюкозы, цитратного цикла и, возможно, АТФ. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета.
Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. В зависимости от характера действия на фосфодиэфирные связи и локализации остатка фосфата различают 3"-нуклеазы, расщепляющие сложноэфирные связи межнуклеозидного фосфата с С 5" , и 5"-нуклеазы, гидролизующие связи c С 3" . Кроме того, различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекуле ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот и образование олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или от олигонуклеотидов.
Помимо гидролитических нуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, в частности посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5-го углеродного атома рибозы одного мононуклеотида ко 2-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2-м и 3-м углеродным атомами рибозы одного и того же мононуклеотида. К настоящему времени открыты следующие группы нуклеаз, катализирующие распад ДНК и РНК.
Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфирных связей в одной из двух цепей молекулы ДНК между 3"-м углеродным остатком дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов:
ДНК + (n - 1) Н 2 O --> n Олигодезоксирибонуклеотиды
Среди продуктов реакции открываются также моно- и динуклеотиды. Типичными представителями этих ферментов являются ДНК-азы поджелудочной железы. Одна из них была получена в чистом виде, расшифрована последовательность всех ее 257 аминокислот. Фермент наиболее активен при pH 6,8-8,0, активируется дивалентными ионами Mg 2+ и Мn 2+ и ингибируется конечными продуктами ферментативной реакции - олигонуклеотидами.
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая молекулярную массу 38 000 дальтон и состоящая из 343 аминокислот. В составе этой ДНК-азы открыт глюкозамин. Фермент также активируется ионами металлов, ингибируется анионами; его оптимум pH колеблется между 4,5 и 5,5.
Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5"-дезоксирибонуклеотидов; в частности, из Е. coli выделено 4 таких фермента, обозначаемых экзодезоксирибонуклеазами I, II, III и IV.
Рестриктазы - ферменты ДНК-азного действия, катализируют распад чужеродной (в основном фаговой) ДНК в строго определенных зонах молекулы, имеющих структуру палиндромов. Из Е. coli выделены и охарактеризованы две такие рестриктазы, обозначаемые EcoRI и EcoRII соответственно. Поскольку рестриктазы действуют на строго определенные участки молекулы, они используются для расшифровки последовательности нуклеотидных остатков в ДНК фагов и вирусов. Более того, это уникальное свойство рестриктаз находит все большее практическое применение в генной инженерии по "вырезанию" определенных фрагментов ДНК и "встраиванию" их в геном бактериальной ДНК, способствуя тем самым передаче клетке ряда не свойственных ей прежде наследственных свойств. Теоретическое и главным образом практическое значение подобных исследований трудно переоценить. Этим объясняется пристальное внимание многих ученых к разработке проблем генной инженерии. Свидетельством огромного интереса к подобным исследованиям является создание в рамках АН СССР и стран - участниц СЭВ комплексной программы - проекта "Рестриктазы".
Из ферментов, катализирующих гидролитический распад РНК, наиболее изученными являются рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. К настоящему времени выделена РНК-аза из поджелудочной железы многих животных. Она состоит из 124 аминокислот во всех РНК-азах, хотя последние несколько различаются по последовательности аминокислотных остатков; выяснена также третичная структура ряда РНК-аз.
Получен в гомогенном состоянии из плесневого гриба аспергилла другой фермент - гуанилорибонуклеаза, катализирующая деполимеризацию РНК с образованием гуанозин-3-фосфата и олигонуклеотидов.
Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотидфосфорилазу и группу ДНК-гликозидаз. Первая открыта в лаборатории С. Очоа еще в 1955 г. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотидфосфорилазы в лаборатории С. С. Дебова; в той же лаборатории фермент открыт в животных тканях. Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат:
Предполагают, что in vivo фермент катализирует распад клеточных РНК, предпочтительнее мРНК, до нуклеозиддифосфатов, участвуя тем самым в регуляции концентрации клеточного неорганического фосфата. Следует указать еще на одну не менее важную уникальную функцию полинуклеотидфосфорилазы - способность фермента катализировать в опытах in vitro синтез из свободных нуклеозиддифосфатов полирибонуклеотидов с заданной последовательностью. Эта функция фермента сыграла выдающуюся роль в расшифровке кода белкового синтеза (см. ниже) в лабораториях лауреатов Нобелевской премии С. Очоа и М. Ниренберга.
Группа ДНК-гликозидаз участвует в акциях отщепления модифицированных пуриновых и пиримидиновых оснований (например, урацила, образовавшегося при дезаминировании остатка цитозина в одной из цепей ДНК). В серии последующих реакций при участии ДНК-полимеразы и ДНК-лигазы брешь восполняется включением соответствующего и отсутствующего мононуклеотида. Таким образом, ДНК-гликозидазы выполняют важную функцию в процессах репарации (восстановления структуры) молекулы ДНК.
В результате последовательного действия разнообразных клеточных экзо- и эндонуклеаз нуклеиновые кислоты подвергаются распаду до стадии рибо- и дезоксирибонуклеозид-3"- и 5"-фосфатов.
Дальнейший распад образовавшихся продуктов связан с ферментативными превращениями мононуклеотидов и нуклеозидов, далее свободных азотистых оснований. Известно, что адениловая кислота, кроме того, подвергается в животных тканях обратимому дезаминированию в инозиновую кислоту. На первом этапе гидролиза действуют 3"- или 5"-нуклеотидазы, катализирующие гидролитический распад мононуклеотидов по уравнению:

На втором этапе распада имеет место перенос остатка рибозы от нуклеозида на свободную фосфорную кислоту с образованием рибозо-1-фосфата и свободного азотистого основания. По этому пути окисляются преимущественно пиримидиновые нуклеотиды (см. ниже).
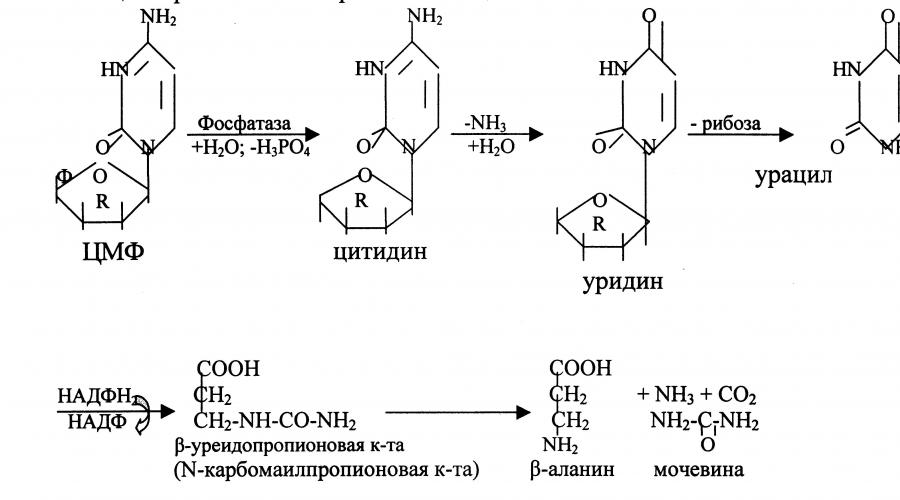
Распад пиримидиновых нуклеозидов Последовательность ферментативных реакций гидролиза пиримидиновых нуклеозидов можно видеть из представленной схемы:
Как видно из приведенной схемы, начальные этапы реакции распада пиримидиновых нуклеотидов катализируются специфическими ферментами; конечными продуктами реакции являются СO 2 , NH 3 , мочевина, β-аланин и β-аминоизомасляная кислота. Следует указать, что гидролитический путь распада пиримидинов является, очевидно, главным путем образования β-аланина, который может служить источником для синтеза ансерина и карнозина (см. Биохимия мышц), а также для образования коэнзима А. Известно, кроме того, что β-аланин в животных тканях подвергается дальнейшему распаду. В частности, в тканях животных открыта специфическая трансаминаза, катализирующая трансаминирование между β-аланином и пировиноградной кислотой. В процессе этой обратимой реакции синтезируются β-аланин и формилацетат (полуальдегид малоновой кислоты): |
21.Распад пуриновых нуклеотидов. Образование мочевой кислоты. Распад пуриновых нуклеотидов может происходить различными путями. Свободный аденин и аденин в составе нуклеотидов дезаминируются, превращаясь в гипоксантин и далее в ксантин (2,6-диоксипурин), который под действием фермента ксантиноксидазы преобразуется в мочевую кислоту. Ксантин образуется и в процессе дезаминирования гуанина. У человека и приматов мочевая кислота является конечным продуктом П. о. и выводится с мочой. Млекопитающие, кроме приматов, выделяют аллантоин - продукт окисления мочевой кислоты, а костистые рыбы - продукт гидратирования аллантоина - аллантоевую кислоту. У амфибий и большинства рыб она гидролизуется до мочевины и глиоксилата.
К наиболее важным нарушениям П. о. относятся избыточное образование и накопление мочевой кислоты, например при подагре (Подагра) и синдроме Леша - Найхана. В основе последнего лежит наследственная недостаточность фермента гипоксантинфосфатидилтрансферазы, вследствие чего свободные пурины не используются повторно, а окисляются в мочевую кислоту. У детей с синдромом Леши - Найхана отмечаются воспалительные и дистрофические изменения. обусловленные отложением в тканях кристаллов мочевой кислоты: заболевание характеризуется задержкой умственного и физического развития. Из других пуриновых оснований, обнаруженных у человека, следует упомянуть метаболических предшественников мочевой кислоты: аминопурины - гуанин, аденин - и оксипурины - гипоксантин, ксантин.
В настоящее время доказаны три основных пути образования мочевой кислоты в организме: а) из пуринов, освобождающихся при тканевом распаде; б) из пуринов, содержащихся в пище; в) из синтетически образуемых пуринов.
Путь образования мочевой кислоты принципиально аналогичен первому с той разницей, что в этом случае пуринсодержащие соединения, превращение которых дает мочевую кислоту, имеют алиментарную природу. При этом отщепление белка от нуклеопротеида начинается в желудке под действием соляной кислоты с пепсином и заканчивается в кишечнике под воздействием трипсина. Образующиеся нуклеиновые кислоты под влиянием ферментов поджелудочной железы и кишечного сока - рибонуклеазы и дезоксирибонуклеазы - распадаются до мононуклеотидов. Последние под действием нуклеотидаз и нуклеозидаз кишечного сока расщепляются соответственно до нуклеозидов и азотистых оснований. Те и другие, а также и часть мононуклеотидов подвергаются всасыванию в кишечнике.
Третий путь образования мочевой кислоты в организме, установленный с помощью изотопов С14 и N15 и др., идет через синтез пуриновых производных, в котором принимают участие глицин, муравьиная и аспарагиновая кислоты, глютамин, углекислый газ.
22.Распад пиримидиновых нуклеотидов. Распад пиримидиновых нуклеотидов начинается с отщепления от них остатка фосфорной кислоты, катализируемого нуклеотидазами. Образовавшиеся нуклеозиды далее расщепляются фосфоролитически с образованием (дезокси)рибозофосфатов и свободных пиримидиновых азотистых оснований. Цитозин подвергается дезаминированию, предшествующему дальнейшей деградации. Для распада пиримидиновых оснований характерен восстановительный путь с последующим размыканием пиримидинового кольца. Из урацила образуется аминокислота β-аланин, из тимина - β-аминоизомасляная кислота, углекислый газ и аммиак. Аминокислоты - продукты деградации пиримидинов - далее могут вступать в разнообразные реакции обмена веществ (см. Азотистый обмен).
Поскольку интенсивность синтеза нуклеиновых кислот регулируется на стадии синтеза пиримидиновых нуклеотидов, П. о. оказывает существенное влияние наобмен нуклеиновых кислот. Один из путей регуляции синтеза пиримидиновых нуклеотидов - ингибирование по механизму обратной связи: избыток ЦТФ - конечного продукта биосинтетических процессов П. о. аллостерически ингибируетфермент, катализирующий синтез карбамоиласпартата (первую реакцию биосинтеза пиримидинов). Пиримидиновые нуклеотиды ингибируют также синтез ряда ферментов пиримидинового обмена.
В быстрорастущих тканях активность ферментов распада пиримидиновых нуклеотидов чрезвычайно низкая; активность ферментов их синтеза (аспартат-карбамоилтрансферазы и др.) резко возрастает в быстро делящихся тканях, например в ткани печени после частичной гепатэктомии.
Генетическое нарушение П. о. может быть причиной наследственных заболеваний, например оротацидурии, при которой наблюдается избыточное выделение с мочой продукта деградации пиримидиновых оснований - оротовой кислоты. Пернициозная анемия сопровождается существенными нарушениями пиримидинового обмена (см.Анемии), а лечебное действие витамина В12 и фолиевой кислоты (см. Витамины) при анемиях обусловлено участием производных этих витаминов в качестве коферментов в реакциях синтеза пиримидиновых оснований.
Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты. В зависимости от числа имеющихся в молекуле остатков фосфорной кислоты различают нуклеозидмонофосфаты (НМФ), нуклеозиддифосфаты (НДФ), нуклео-зидтрифосфаты (НТФ).
В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин(А), гуанин(G) и пиримидиновые - цитозин(С), тимин (Т) и урацил(U ). Нумерация атомов в основаниях записывается внутри цикла.
Пиримидины распадаются до аммиака, углекислого газа и воды
Распад пиримидиновых нуклеотидов происходит параллельно, с использованием одинаковых реакций и ферментов. Можно отметить несколько специфичных ферментов:
1. Фермент 5"-нуклеотидаза отщепляет 5"-фосфатную группу от ЦМФ, УМФ и ТМФ.
2. Дезаминаза проводит окислительное дезаминирование цитидина.
3. Нуклеозид-фосфорилаза удаляет рибозу от уридина и тимидина.
4. Дигидроурацил-дегидрогеназа – восстановление урацила и тимина.
5. Дигидропиримидиназа осуществляет гидролитическое расщепление пиримидинового кольца.
7. После окончательного разрушения пиримидинового кольца появившиеся β-аминокислоты направляются в реакции трансаминирования , после чего соответствующие кетокислоты изомеризуются и далее сгорают в ЦТК.

Строение пуриновых нуклеотидов (знать формулы). Распад пуриновых нуклеотидов.
Каждый нуклеотид содержит 3 химически различных компонента: гетероциклическое азотистое основание, моносахарид (пентозу) и остаток фосфорной кислоты.
В состав нуклеиновых кислот входят азотистые основания двух типов: пуриновые - аденин(А), гуанин(G) и пиримидиновые

Пурины распадаются с образованием мочевой кислоты
Наиболее активно катаболизм пуринов идет в печени, тонком кишечнике (пищевые пурины) и почках.
Реакции катаболизма пуринов
Реакции распада пуринов можно условно разделить на 5 стадий:
1. Дефосфорилирование АМФ и ГМФ – фермент 5"-нуклеотидаза.
2. Гидролитическое отщепление аминогрупы от С6 в аденозине – фермент дезаминаза. Образуется инозин.
3. Удаление рибозы от инозина (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорилированием – фермент нуклеозидфосфорилаза.
4. Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза.
5. Окисление С8 в ксантине с образованием мочевой кислоты – фермент ксантиноксидаза. Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки.
98.Синтез пуриновых и пиримидиновых азотистых оснований. Роль витамина .
Синтез пуриновых оснований происходит во всех клетках организма, главным образом в печени. Исключение составляют эритроциты, полиморфноядерные лейкоциты, лимфоциты.
Условно все реакции синтеза можно разделить на 4 этапа:
1. Синтез 5"-фосфорибозиламина

2. Синтез инозинмонофосфата

5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные тетрагидрофолиевой кислоты (ТГФК). В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ.
Синтез аденозинмонофосфата и гуанозинмонофосфата
I. Гуанозинмонофосфат (ГМФ) образуется в двух реакциях – сначала он окисляется ИМФ-дегидрогеназой до ксантозилмонофосфата, источником кислорода является вода, акцептором водорода – НАД. После этого работает ГМФ-синтетаза, она использует универсальный клеточный донор NH2-групп – глутамин, источником энергии для реакции служит АТФ.

II. Аденозинмонофосфат(АМФ) также образуется в двух реакциях, но в качестве донора NH2-группы выступает аспарагиновая кислота. В первой, аденилосукцинат-синтетазной, реакции на присоединение аспартата используется энергия распада ГТФ, во второй реакцииаденилосукцинат-лиаза производит удаление части аспарагиновой кислоты в виде фумарата.
Роль витамина В9.
Первая из важных ролей витамина В, которая была определена при открытии этого вещества, состояла в уменьшении проявлений анемии. Фолиевая кислота поставляет частицы углерода, необходимые для синтеза гемоглобина, поэтому становится активным участником кроветворения. Доказана и значительная роль витамина В9 в синтезе кровяных телец, выполняющих роль защитников организма и укрепляющих иммунитет.
Еще одна важная роль фолиевой кислоты, которая роднит это вещество с другими витаминами группы В – обеспечение нормальной работы нервной системы. Витамин В9 входит в состав спинномозговой жидкости и регулирует передачу нервных импульсов возбуждения и торможения. Уровень этого витамина коррелирует с нашей памятью и работоспособностью
Фолиевая кислота принимает участие в синтезе некоторых гормонов, в частности норадреналина и серотонина, которые отвечают за работу сердца и сосудов, тонус желудочно-кишечного тракта, сопротивляемость стрессам, хорошее настроение и нормальный сон.
Витамин В9 необходим для синтеза аминокислот метионина и гомоцистеина. Эти аминокислоты незаменимы. При их недостатке возрастает риск повреждения кровеносных сосудов и образования тромбов, развития инсульта. При участии фолиевой кислоты синтезируются и аминокислоты ДНК, РНК, необходимые элементы клеточных ядер и оболочек.
Доказано участие фолиевой кислоты в окислительных и восстановительных процессах на клеточном уровне, в сохранении структуры клеток и защите от разрушений свободными радикалами. Без фолиевой кислоты не обходится выработка желудочного сока и желчных кислот в печени, она влияет на активность мужских половых клеток и поддержание фертильности. Витамин В9 непосредственно участвует в восстановлении мышечной ткани, формировании и росте тканей кожи, слизистых оболочек желудка и кишечника, костного мозга.
Функции витамина В9
Фолиевая кислота решает многие важные задачи в организме, исходя из биологической роли этого вещества и влияния на ключевые процессы в органах и системах:
· предотвращает развитие анемии;
· уменьшает негативное стрессовое воздействие;
· предохраняет от послеродовой депрессии;
· корректирует уровень фертильности и качество мужской спермы;
· помогает легче перенести климактерические изменения;
· снижает риск инфаркта, инсульта, атеросклероза, стенокардии;
· нормализует артериальное давление;
· улучшает память, мыслительную деятельность и работоспособность;
· поддерживает иммунную систему.
