Ванадий порядковый номер. Производство и получение ванадия
Читайте также
Ванадий имеет объемноцентрированную кубическую решетку с периодом а=3,0282А. В чистом состоянии Ванадий ковок, легко поддается обработке давлением. Плотность 6,11 г/см3; t пл 1900°С, t кип 3400°С; удельная теплоемкость (при 20-100°С) 0,120 кал/г·град; термический коэффициент линейного расширения (при 20-1000°С) 10,6·10-6 град-1; удельное электрическое сопротивление при 20°С 24,8·10-8ом·м (24,8·10-6 ом·см); ниже 4,5 К Ванадий переходит в состояние сверхпроводимости. Механические свойства Ванадия высокой чистоты после отжига: модуль упругости 135,25 н/м 2 (13520 кгс/мм 2), предел прочности 120 мн/м 2 (12 кгс/мм 2), относительное удлинение 17%, твердость по Бринеллю 700 мн/м 2 (70 кгс/мм 2). Примеси газов резко снижают пластичность Ванадия, повышают его твердость и хрупкость.
Химические свойства Ванадия
На воздухе Ванадий не изменяется, устойчив он к воде, к растворам минеральных солей и щелочей. Кислоты на него действуют только такие, которые одновременно являются окислителями. На холоде на него не действуют разбавленные азотная и серная кислоты. По-видимому, на поверхности металла образуется тончайшая пленка оксида, препятствующая дальнейшему окислению металла. Для того чтобы заставить Ванадий интенсивно реагировать, его нужно нагреть. При 600-700°С происходит интенсивное окисление компактного металла, а в мелкораздробленном состоянии он вступает в реакции при более низкой температуре .
Прямым взаимодействием элементов при нагревании могут быть получены сульфиды, карбиды, нитриды, арсениды, силициды. Для техники важны желто-бронзовый нитрид VN (t пл = 2050°С), устойчивый к воде и кислотам, а также обладающий высокой твердостью карбид VC (t пл = 2800 °С).
Ванадий очень чувствителен к примесям газов (O 2 , N 2 , H 2), которые резко меняют его свойства, даже если присутствуют в самых незначительных количествам. Поэтому и сейчас можно в разных справочниках встретить различную температуру плавления Ванадия. Загрязненный Ванадий, в зависимости от чистоты и способа получения металла, может плавиться в интервале от 1700 до 1900°С. При чистоте 99,8 - 99,9 % его плотность равна 6,11 г/см3 при 20°С, температура плавления составляет 1919°С, а температура кипения 3400 °С.
Металл исключительно стоек как в органических, так и в большинстве неорганических агрессивных средах. По стойкости к действию НС1, НВr и холодной серной кислоты он значительно превосходит титан и нержавеющую сталь. С галогенами, за исключением самого агрессивного из них - фтора, соединений не образует. С фтором же дает кристаллы VF 5 , бесцветные, возгоняющиеся без превращения в жидкость при 111°С. Атмосфера из углекислого газа на металлический Ванадий действует значительно слабее, чем на его аналоги - ниобий и тантал. Он обладает высокой стойкостью к расплавленным металлам, поэтому может применяться в конструкциях атомных реакторов, где расплавленные металлы используются как теплоносители. Ванадий не ржавеет ни в пресной, ни в морской воде, ни в растворах щелочей .
Из кислот на него действуют концентрированная серная и азотная кислоты, плавиковая и их смеси.
Особенностью Ванадия считается высокая растворимость в нем водорода. В результате такого взаимодействия образуются твердые растворы и гидриды. Наиболее вероятная форма существования гидридов - металлообразные соединения с электронной проводимостью. Они способны довольно легко переходить в состояние сверхпроводимости. Гидриды Ванадия могут с некоторыми твердыми или жидкими металлами образовывать растворы, в которых повышается растворимость водорода.
Самостоятельный интерес представляют карбиды Ванадия, так как по своим качествам дают для современной техники материал с весьма ценными свойствами. Они исключительно тверды, тугоплавки и обладают хорошей электрической проводимостью. Ванадий способен для образования своих карбидов даже вытеснить другие металлы из их карбидов:
3V + Fе3С = V 3 С + 3Fе
Известен целый ряд соединений ванадия с углеродом :
V 3 С; V 2 C; VC; V 3 С 2 ; V 4 С 3
С большинством членов главной подгруппы Ванадий дает соединения как бинарные (т.е. состоящие только из двух элементов.), так и более сложного состава. Нитриды образуются при взаимодействии порошка металла или его оксидов с газообразным аммиаком:
6V + 2NН 3 = 2V 3 N + 3Н 2
V 2 О 2 + 2NH 3 = 2VN + 2H 2 О + H 2
Для, полупроводниковой техники интерес представляют фосфиды V 3 Р, V 2 P, VP, VP 2 и арсениды V 3 As, VAs.
Комплексообразующие свойства Ванадия проявляются в образовании соединений сложного состава типа фосфорно-ванадиевой кислоты H 7 PV 12 O 36 или Н 7 [Р(V 2 O 6) 6 ].
Металл серебристо - белого цвета, который при нагреве до температуры 300 градусов Цельсия склонен к насыщению различными газами, например, кислородом или азотом, называют ванадием. Металл ванадий и его цена за 1 кг лома на сегодня лежит в диапазоне от нескольких десятков до тысяч долларов США - это химический элемент, занимающий в таблице Менделеева место под номером 23. Он расположен между титаном и хромом.
Ванадий - это тугоплавкий металл, температура плавления составляет 1735 ºC. Он часто встречается в земной коре, по некоторым расчётам, его объем составляет до 0,005%, от земной коры. Его можно встретить в составе более чем полусотни минералов. Для нужд экономики ежегодно добывают 10 000 тонн этого металла.
Кстати, специалисты горного дела считают рентабельными выработки с рудой, содержащей более 0,1% ванадия.
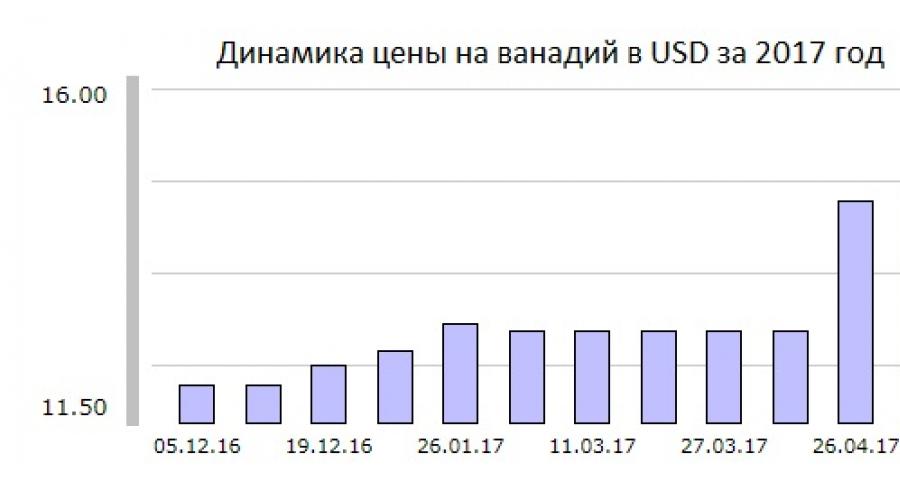
Цена ванадия за 1 кг лома
Роль ванадия в промышленности сложно переоценить. Более того если посмотреть на динамику добычи этого материала, то сразу будет видно, что ежегодный прирост составляет до 1,5%. Ключевыми игроками в этой части рынка можно назвать следующие страны:
- Китай;
- Российская Федерация.
На долю остальных государств приходиться всего несколько процентов от мирового объема, между тем как «Поднебесная» контролирует более трети рынка. По оценкам некоторых экспертов - до 36%.

Следует отметить и то, что рост добычи был спровоцирован увеличением объемов потребления ванадия и его производных в металлургической промышленности. И вновь - Китай впереди всех. Такая ситуация не может не отразится не уровне цен на этот металл и его соединения.
Цена на сентябрь 2018 года за кг ванадия составляет 16 долларов США или 900 рублей.
Говоря о цене на этот продукт надо понимать что на рынке в РФ представлено несколько позиций продукции, содержащий в себе ванадий. Это:
- Полоса;
- Проволока;
- Слиток;
- Проволока и пр.
При этом на рынке РФ активно работает несколько компаний, большинство из которых, расположены в Москве. В зависимости от типа продукции существенно разнится цена.
Так к примеру, ВНПЛ-1 (полоса) достигает стоимости в Москве 2026 USD, а ВНМ - 1 (слиток) 211.
Такой уровень цен обусловлен в первую очередь сложностью потребления и конечно спросом со стороны потребителей.
Применение ванадия в промышленности
Изначально, ванадий применяли для получения цветного стекла, керамических изделий и красок. Соединения, полученные на основании ванадия придавали неповторимый голубой или зелёный цвет стекольным изделиям. В том время как фарфор и керамика получали золотистую глазурь полученную из веществ, полученных из ванадия.
Оксид ванадия, произвёл значительный прорыв в теле окрашивания тканей, произведённых из хлопка и шелка.
Первая мировая война вызвала всплеск интереса к ванадию, точнее к серной кислоте, которую производили с помощью этого металла. Именно при получении кислоты, ванадий стали использовать как заменитель платины, которую использовали как катализатор.
Ванадий и металлургия
В отличии от химической отрасли, обходящейся ванадиевыми производными, металлургическая промышленность использует его в чистом виде. Все дело в том, что этот металл применяют как легирующий элемент.
После аварии, случившейся на гонках, обломок двигателя попал в руки Генри Форда - старшего, который и вызвал его к себе необычайной твёрдостью, вязкостью и малым весом. После проведённых анализов стало понятно, что двигатель был изготовлен из стали с примесью ванадия.

Исследования, выполненные в компании Форда, позволили получить стальные сплавы отличающиеся низкой массой, высокой прочностью. В следствие этого автомобили получили улучшенные ходовые характеристики, жёсткость и прочность конструкции. Кстати, после этого, Генри Форд и произнёс фразу, приведённую выше.
Примерно в то же время инженеры из разных стран использовали ванадиевые стали для получения брони, изготовления оружейных стволов, установленных, в том числе и на авиационных пушках и пулемётах.
Можно отметить, что для изготовления армейских касок во время Первой мировой войны применяли кремниевые и никелевые добавки, но только использование ванадиевых присадок, позволило добиться желаемых результатов. При этом, содержание ванадия в стали достигало всего 0,2%. Надо отметить, что использование этого металла позволило снизить вес и цены на изделия для военных. Изготовление стали с добавлением ванадиевых и хромовых компонентов, обладающей высокой усталостной прочностью, позволило увеличить выпуск авиационных моторов, торпед, бронебойных боеприпасов и пр. Кстати, появление таких сталей привело к снижению цены на готовую продукцию.
Некоторые особенности использования ванадия
Специалисты знают, что использование ряда элементов изменяет свойства стали. Например, молибден обеспечивает хорошую прокаливаемость, никель повышает вязкость. Но и тем не менее, какое влияние может оказать та или иная добавка можно определить не всегда. Между тем, ответ на вопрос, почему ванадий оказывает хорошее воздействие на стали лежит на поверхности.

Все дело в свойствах этого металла. В процессе изготовления расплав стали активно впитывает в себя различные газы. По мере остывания, в стальном слитке образуются микроскопические пузырьки. При дальнейшей обработке, например, ковке, он изменяют форму и его прочность становиться разной. После введения в расплав ванадия, он вступает в реакцию с проникшими газами, а это в свою очередь приводит к образованию шлаков , которые всплывают и удаляются в процессе плавки. Оставшийся в стали ванадий образует твёрдые и жаростойкие соединения, их называют карбиды. Они препятствуют появлению крупных кристаллов. После остывания сталь получается мелкозернистой, обладающей высокой твёрдостью и ковкостью.
Наличие ванадия в стали позволяет ей сохранять свои свойства при высоких температурах, которых появляются при обработке, например, при точении или шлифовании.
Кроме того, ванадиевые добавки, гарантируют наличие мелкокристаллической структуры материала.
Ещё свойство, которое появляется у стали, полученной с ванадиевыми добавками - стойкость к истиранию.
Так, цилиндры, применяемые в дизельных двигателях и изготовленные из качественной углеродистой стали, после пробега в тысячу моточасов теряют до 0,4 мм в толщине стенки, в то время, как те, которые выполнили из ванадиевой стали всего 0, 1 мм. Это не только повышают ресурс двигателя, но и снижают эксплуатационную стоимость.
Кстати, ванадий применяют не только в получении стали. Его применяют при производстве алюминиевого сплава под названием Вавилим. Он применяется при производстве машин и механизмов работающих под воздействием морской воды.
Ванадий применяют при производстве лабораторной посуды, инструментальных сталей. Даже качественные духовые музыкальные инструменты не обходятся без его участия.
На основании вышесказанного можно сказать следующее - применение ванадия и его соединений позволяет не только улучшить свойства различных материалов, но и снизить их эксплуатационные свойства.
Ванадий в человеческом организме
Без этого элемента не обходится и наш организм. В частности ванадий оказывает следующее воздействие:
- замедляет процессы старения;
- усиливает процессы обмена веществ;
- замедляет процесс выработки холестерина;
- положительно влияет на работу цнс, органов пищеварения и пр.;
- стабилизирует работу сердечно-сосудистой системы, в том числе снижает кровяное давление.
Надо отметить, что это малая часть его положительного влияния ванадия на человеческий организм. Именно поэтому этот элемент и его производные входят в состав различных медикаментов и витаминов, которые можно приобрести во многих аптеках нашей страны, в том числе и Москвы.
Производство ванадия, формы поставки
Сложностью технологического процесса и трудоёмкостью отличается производство ванадия и изделий из него. Это вызвано в первую очередь тем, что ванадиевая руда имеет сложный состав и малое содержание искомого урана. Именно поэтому, использование традиционных методов обогащения руды не представляется возможным.
Общие сведения и методы получения
Ванадий (V) - металл серо-стального цвета.
Открыт в 1801 г. мексиканским минералогом А. М. дель Рио в свинцовой руде Самапанского месторождения. Позднее в 1830 г. шведский химик Сефстрем, анализируя пробы железной руды месторождения Та-борг, обнаружил в них новый элемент. Ои и дал ему название- по имени легендарной северной богини красоты Ванадис.
Металлический порошок ванадия серебристо-белого цвета путем восстановления VC1 2 водородом впервые получил английский химик Роско в 1869 г. Пластичный ковкнй ванадий получен лишь в 1927 г. Морде-ном н Ричем путем восстановления оксида ванадия (V) кальцием.
Промышленное значение металл приобрел лишь в начале XX в. Использование его в металлургическом производстве в нашей стране в виде феррованадия началось с 1936 г.
Содержание ванадия в земной коре 1,5*10 -2 % (по массе). Ванадиевые руды очень редки. Ванадий, как правило, находится в полиметаллических рудах других металлов, в частности свинцовых, свинцово-медных и свинцово-цинковых, а также в железных рудах, обычно представляющих собой титаномагнетиты. В некоторых магматических рудах концентрация ванадия достигает 1 % V2O5.
Известно более 65 минералов, содержащих ванадий, из которых промышленное значение имеют: патронит, карнотит, роскоэлит, моттрамит, дуклуазит, ванадинит.
Из ванадийсодержащих руд (или их концентратов) ванадий извлекают либо непосредственным выщелачиванием растворами кислот и щелочей, либо выщелачиванием продукта окислительного обжига (в смеси с поваренной солью) водой или разбавленными кислотами. Из растворов путем гидролиза выделяют оксид ванадия (V) V 2 0 5 который используют для выплавки феррованадия, а также производства металлического ванадия.
Металлический ванадий получают либо непосредственным восстановлением оксида (V), либо в две стадии, т.е. сначала восстанавливают оксиды (V) до низшего оксида с использованием одного восстановителя, а затем низший оксид - до металла другим восстановителем.
Разработан ряд методов получения металлического ванадия: каль-цнетермический, при котором ковкий ванадий получают методом восстановления оксидов ванадия кальцием; алюминотермический, когда основным восстановителем металла является алюминий; метод вакуумного углетермического восстановления оксидов ванадия (использование углерода наиболее перспективно); хлоридный, при котором хлорид ванадия (VC1 3) восстанавливается жидким магнием.
Существует также иодидный метод, заключающийся в диссоциации иодида (VI 2) и обеспечивающий получение ванадия наиболее высокой чистоты, однако этот метод пока может быть использован лишь для получения небольших количеств высокочистого металла.
Каждый из рассмотренных методов имеет свои преимущества и недостатки, поэтому выбор того или иного метода определяется задачами в отношении качества конечного продукта, а также экономическими соображениями и возможностями осуществления самого процесса.
Физические свойства
Атомные характеристики. Атомный номер 23, атомная масса 50,942 а. е. м., атомный объем 8,35■ 10~ 6 м 3 /моль. Атомный радиус 0,134 нм, ионный радиус V 2+ 0,072 нм, V 3 + 0,067 нм, V 4 + 0,061 им, V 5 + 0,04 нм. Конфигурация внешних электронных оболочек 3d 3 4s 2 . Электроотрица-тельиость 1,6.
Химические свойства
В соединениях проявляет степень окисления от +2 до +5, наиболее стойки и типичны соединения со степенью окисления +5.
Ванадий обладает высокой химической стойкостью в воде, водных растворах минеральных солей, разбавленной соляной кислоте и в растворах щелочей. На холоду на него действуют разбавленные азотная и серная кислоты. Плавиковая кислота, концентрированные азотная и серная кислоты, царская водка растворяют ванадий.
Ванадий достаточно устойчив на воздухе при температурах, не превышающих 300 °С. Взаимодействия его с азотом, кислородом и водородом усиливаются при 600-700 °С.
Оксид ванадия (IV) V 2 0 4 получают при слабом нагревании V2O5 с углем, сплавлением V 2 0 5 со щавелевой кислотой, медленным окислением па воздухе V 2 0 3 . Оксид V 2 0 4 амфотерен; при растворении V 2 0 4 и его гидратов в неокисляющнх кислотах образуются растворы солей ванадия, при растворении V 2 0 4 в щелочах - растворы солей тетрава-надистой кислоты.
Оксид ванадия (V) V 2 0 5 получают нагреванием метаванадата аммония на воздухе, гидролизом VOCl 3 , нагреванием на воздухе или в кислороде порошкообразного ванадия, низших его оксидов и карбида. V 2 05 имеет две модификации: аморфную и кристаллическую. Водные растворы V 2 0 5 имеют кислую реакцию, реатруя со щелочами, дают соли.
С фтором ванадий образует фториды VF, VF 4 , VF 5 , VF 3 -3H 2 0.
Трифторид ванадия VF 3 получают взаимодействием HF с VC1 3 при температуре темно-красного каления Если упаривать раствор V 2 0 3 во фтористоводородной кислоте, выделяется VF 3 -3H 2 0.
Тетрафторид ванадия VF 4 получают взаимодействием сухого фтористого водорода с VC1 4 .
Известны хлориды ванадия- VCI 2 , VC1 3 , VCI 4 , VOCl, V0C1 3 . Дихло-рид VCl 2 получают путем пропускания паров VC1 4 и Н 2 через стеклянную трубку, нагретую до темно-красного каления, или действием газообразного НС1 на феррованадий. VC1 2 - сильный восстановитель, выделяет металлы из растворов солей золота, серебра, платины.
Трихлорид VCI 3 получают при нагревании VCl 4 ; фиолетово-красиые кристаллы VC1 3 , хорошо растворимые в воде.
Тетрахлорид VCI 4 получают хлорированием феррованадия хлором прн 150-200 °С.
Оксихлорид ванадия V0C1 - кристаллическое вещество, получаемое нагреванием VC1 4 в атмосфере С0 2 при ~700°С или восстановлением VOCI3 водородом при температуре красного каления.
Окситрихлорид ванадия VOCI 3 получают нагреванием V 2 0 5 и токе С1 2 при -600 °С.
Дииодид ванадия VI 2 получают синтезом; он не растворяется в абсолютном спирте, бензоле, тетрахлориде углерода, сероуглероде; на воздухе частично окисляется.
Трииодид ванадия VI 3 получают нагреванием смеси элементов при 300 °С; он растворяется в воде, в абсолютном спирте, не растворяется в бензоле, тетрахлориде углерода, сероуглероде.
Известны три сульфида ванадия. VS, V 2 S 3 и V 2 S 5 .
Сульфид ванадия VS получают нагреванием V 2 S в среде водорода при 850-1100 "С или сплавлением V 2 0 5 с серой при 400 °С в атмосфере С0 2 VS легко окисляется на воздухе, легко взаимодействует с HN0 3 .
Диванадийтрисульфид V 2 S 3 получают, воздействуя CS 2 на V 2 0 5 при 700 °С, пентасульфид ванадия V 2 Ss - при нагревании на воздухе V 2 S 3 с избытком серы при 400 "С.
С азотом ванадий образует нитриды. VN 2 получается взаимодействием aioia с порошком ванадия при 750-850 "С, окисляется во влажном воздухе, реагирует с горячей HN0 3 . VN отличается высокой химической стойкостью; HCI и H 2 S0 4 на пего не Действуют, HN0 3 его окисляет.
Ванадий растворяет водород, причем растворимость уменьшается с повышением температуры. Максимальное количество водорода, которое ванадий может удерживать при комнатной температуре ~4 % (ат.).
Ванадий является перспективным металлом для создания сплавов, работающих при температурах, более высоких, чем никелевые и кобальтовые жаропрочные сплавы.
Наиболее распространенными легирующими добавками ванадиевых сплавов являются титан, ниобий, вольфрам, цирконий.
В системах ванадия с РЗМ наблюдаются широкие области расслоения в жидком и твердом состояниях, незначительная растворимость РЗМ в твердом ванадии.
Ванадий образует с 6-титаном непрерывный ряд твердых растворов, а с а-титаном - ограниченные твердые растворы; в системах с цирконием и гафнием имеются соединения ZrV 2 и HfV 2 .
Ниобий и тантал, расположенные с ванадием в одной подгруппе неограниченно в нем растворимы в жидком и твердом состояниях. Однако для этих систем характерен распад твердых растворов при низких температурах.
Непрерывные ряды твердых растворов наблюдаются в системах ванадия с хромом, молибденом и вольфрамом.
Электрохимический эквивалент ванадия 0,10560 мг/Кл.
Технологические свойства
Нелегированный ванадий - мягкий металл, легко поддающийся пластической деформации. Предельное суммарное содержание примесей азота и кислорода в ванадии, при котором сохраняется пластичность, позволяющая проводить обработку давлением, по мнению ряда исследователей, составляет 0,2 %.
В процессе холодной пластической деформации наиболее значительное упрочнение ванадия достигается при обжатии до 15 %. При более высоких обжатиях интенсивность упрочнения снижается.
Температура начала рекристаллизации ванадия высокой степени чистоты 700-800 °С При легировании ванадия тугоплавкими металлами (Nb, Hf, Ti и др.) температура рекристаллизации повышается до 980-1100 "С.
Температура ковки и прессования слитков 1000-1450 "С.
Горячую обработку давлением производят с нагревом в атмосфере аргона и других инертных газов. Для защиты от окисления и охруп-чивания ванадия газовыми примесями при нагреве используют также гальванические покрытия. Лучшие результаты получены прн покрытии никелем. Применяют также кремниевые покрытия.
Предварительно деформированные заготовки ванадия обрабатывают давлением в холодном состоянии (прокатка, волочение или другие методы).
Из пластичного ванадия в холодном состоянии без промежуточных отжигов можно изготовлять листы, прутки, тонкостенные трубы, проволоку и т. п.
Добавки вольфрама и тантала снижают пластичность сплавов ванадия. Наиболее пластичны сплавы систем V- Ti и V- Zr.
Из сплавов ванадия, содержащих 5-20 % Ti, можно получать листы, прутки, трубы и другие изделия. Сплавы ванадия с содержанием до 40 % Ti и небольшими добавками других элементов наиболее перспективны. Добавка 0,5-1,0 % С к этим сплавам способствует измельчению структуры и улучшению способности к деформированию ковкой.
У сплавов системы V- Zr пластичность повышается при содержании до 3 % Zr, но заметно снижается при более высоком содержании этого элемента. Добавка иттрия также улучшает пластичность ванадия.
Пластичность сплава с 1 % Si такая же, как и чистого ванадия Сплавы V- Nb обладают малым запасом пластичности даже при очень высоких температурах.
Сварку ванадия плавлением можно производить электрической дугой в инертных газах- без присадочного материала, вольфрамовым электродом и электронным лучом в вакууме.
При сварке нелегированиого ванадия образуются пластичные соедч- нения, допускающие изгиб на 180° (при радиусе оправки, равном толщине свариваемых деталей); прочность сварных соединений, выполненных без присадочного металла, равна прочности исходного материала.
Таким образом ванадий можно соединять с титаном, ниобием, танталом, хромом и медными сплавами, а также со сталями, содержащими не более 7-8 % Ni.
Нелегироваииый ванадий легко обрабатывается резанием, как медь.
Для получения хорошей поверхности рекомендуется в качестве смазки применять керосин и высокую скорость резания с небольшой подачей. Высоколегированный ванадий обычно обрабатывается значительно труднее, чем нелегированный, и в случае затруднений с удалением твердого поверхностного слоя режущим инструментом он должен быть удален шлифовкой.
Области применения
Основная область применения ванадия - черная металлургия, где его широко используют в виде феррованадия для получения сталей специального назначения. При введении в сталь 0,15-0,25 °/о V резко повышаются ее прочность, вязкость, сопротивление усталости и износостойкость. Ванадий - сильный раскислитель стали и карбидообразующий элемент, способствующий измельчению структуры стали и чугуна, а также замедлению роста зерна при нагреве.
Ванадий используется также в производстве сплавов на основе титана и на основе других тугоплавких металлов, предиазиачениых для новой техники (авиационной, ракетной, ядерной энергетики). В частности, для.реакторостроеиня ванадий представляет особый интерес, поскольку обладает малым эффективным поперечным сечением захвата нейтронов и одновременно обладает достаточно высокими свойствами при повышенных температурах.
Ванадий применяют как промежуточный материал (прослойка) при плакировании стали и тугоплавких металлов титановыми, циркониевыми сплавами, а также сплавами благородных металлов.
Благодаря высокой коррозионной стойкости в агрессивных химических средах ванадий является перспективным материалом для химического машиностроения и др.
Чистый металлический ванадий используют, кроме того, в производстве электронных приборов, отдельных деталей рентгеновской аппаратуры и т. д.
Ванадий служит основой сверхпроводящих сплавов и других сплавов со специальными свойствами.
Соединения ванадия находят применение во многих областях промышленности, в частности в химической - как катализаторы, в текстильной, лакокрасочной, резиновой, керамической, стекольной, в сельском хозяйстве, медицине и др
Среди известных сегодня 115 химических элементов многие получали свое название в честь героев греческих мифов, богов. Другие называли по фамилии первооткрывателей и известных ученых. Третьи именовались по странам, городам, географическим объектам. Особенно интересна история названия такого элемента, как ванадий. Да и сам по себе этот металл достаточно важный и обладающий особыми характеристиками. Поэтому рассмотрим его подробнее.
Ванадий - химический элемент в таблице Менделеева
Если характеризовать данный элемент по положению в то можно выделить несколько основных пунктов.
- Располагается в четвертом большом периоде, пятой группе, главной подгруппе.
- Порядковый номер - 23.
- Атомная масса элемента - 50,9415.
- Химический символ - V.
- Латинское название - vanadium.
- Русское название - ванадий. Химический элемент в формулах читается как "ванадий".
- Является типичным металлом, проявляет восстановительные свойства.
По положению в системе элементов очевидно, что как простое вещество данный элемент будет иметь свойства, схожие с таковыми у тантала и ниобия.
Особенности строения атома
Ванадий - химический элемент, которого выражается общей электронной формулой 3d 3 4s 2 . Очевидно, что благодаря такой конфигурации и валентности, и степени окисления могут проявлять неодинаковые значения.
Данная формула позволяет предсказать свойства ванадия как простого вещества - это типичный металл, образующий большое количество различных соединений, в том

Характерная валентность и степень окисления
Благодаря наличию трех неспаренных электронов на 3d подуровне ванадий может проявлять степень окисления +3. Однако она не единственная. Всего выделяют четыре возможные значения:

При этом ванадий - которого также имеет два показателя: IV и V. Именно поэтому соединений у данного атома просто множество, и все они имеют красивую цветную окраску. Особенно этим славятся водные комплексы и соли металла.
Ванадий: химический элемент. История названия
Если говорить об истории открытия данного металла, то следует обратиться к к началу XVIII века. Именно в этот период, в 1801 году, мексиканец дель Рио сумел обнаружить неизвестный ему элемент в составе свинцовой горной породы, образец которой он исследовал. Проведя ряд опытов, дель Рио получил несколько красиво окрашенных солей металла. Он дал ему название "эритрон", однако позже принял его за соли хрома, поэтому пальму первенства в открытии не получил.
Позже другой ученый, швед Сефстрем, сумел получить этот металл, выделив его из состава железной руды. У этого химика сомнений в том, что элемент новый и неизвестный, не было. Поэтому первооткрывателем является именно он. Вместе с Йенсом Берцелиусом он дал название открытому элементу - ванадий.
Почему именно такое? В древнескандинавской мифологии есть одна богиня, которая является олицетворением любви, стойкости, верности и преданности. Она же Ее имя было Ванадис. После того как учеными были изучены свойства соединений элемента, им стало совершенно очевидно, что они очень красивые, цветные. А добавка металла к сплавам резко повышает их качество и прочность и устойчивость. Поэтому в честь богини Ванадис и было дано название необычному и важному металлу.

Ванадий - химический элемент, который в виде был получен еще позже. Лишь в 1869 году английский химик Г. Роско сумел выделить металл в свободном виде из горной породы. Другим ученым Ф. Веллером было доказано, что обнаруженный когда-то дель Рио "хром" является ванадием. Однако мексиканец до этого дня не дожил и о своем открытии так и не узнал. В Россию название элемента пришло благодаря Г. И. Гессу.
Простое вещество ванадий
Как простое вещество рассматриваемый атом представляет собой металл. Он обладает рядом физических свойств.
- Цвет: серебристо-белый, блестящий.
- Хрупкий, твердый, тяжелый, так как плотность составляет 6,11 г/см 3 .
- Температура плавления - 1920 0 С, что позволяет отнести его к тугоплавким металлам.
- На воздухе не окисляется.

Так как в свободном виде встретить его в природе невозможно, то людям приходится выделять его из состава различных минералов и пород.
Ванадий - химический элемент-металл, который проявляет достаточно высокую химическую активность при нагревании и определенных условиях. Если же говорить о стандартных параметрах окружающей среды, то он способен реагировать лишь с концентрированными кислотами, царской водкой.
С некоторыми неметаллами формирует бинарные соединения, реакции проходят при больших температурах. В расплавах щелочей растворяется, формируя комплексы - ванадаты. Кислород как сильный окислитель растворяется в ванадии, причем тем больше, чем выше температура нагревания смеси.
Нахождение в природе и изотопы
Если говорить о распространенности рассматриваемого атома в природе, то ванадий - химический элемент, который относится к рассеянным. Он входит в состав практически всех крупных горных пород, руд и минералов. Но нигде его не бывает больше 2%.
Это такие породы, как:
- ванадинит;
- патронит;
- карнотит;
- чилеит.
Также можно встретить рассматриваемый металл в составе:
- золы растений;
- океанской воды;
- тел асцидий, голотурий;
- организмов наземных растений и животных.
Если говорить об изотопах ванадия, то их всего два: с массовым числом 51, которого подавляющее большинство - 99,77%, и с массовым числом 50, который является рассеянным радиоактивным и встречается в ничтожных количествах.

Соединения ванадия
Выше мы уже указывали на то, что как химический элемент данный металл проявляет достаточную активность, чтобы сформировать большое количество различных соединений. Так, известны следующие типы веществ с участием ванадия.
- Оксиды.
- Гидроксиды.
- Бинарные соли (хлориды, фториды, бромиды, сульфиды, йодиды).
- Оксисоединения (оксихлориды, оксибромиды, окситрифториды и прочие).
- Комплексные соли.

Так как валентность элемента варьируется достаточно широко, то и веществ получается немало. Главная отличительная особенность всех их - это окраска. Ванадий - химический элемент, разбор соединений которого показывает, что цвет может колебаться от белого и желтого до красного и синего, включая оттенки зеленого, оранжевого, черного и фиолетового. Отчасти именно это послужило причиной, по которой дали название атому, ведь это действительно выглядит очень красиво.
Однако многие из соединений получаются лишь при достаточно жестких условиях проведения реакции. Кроме того, большинство из них - токсичные, опасные для человека вещества. Агрегатное состояние веществ может быть самым разным. Например, хлориды, бромиды и фториды - чаще всего темно-розовые, зеленые или черные кристаллы. А оксиды - в виде порошков.
Получение и применение металла
Получают ванадий, выделяя его из горных пород и руд. Причем те минералы, которые содержат даже 1% металла, считаются чрезвычайно богатыми на ванадий. После отделения образца смеси железа и ванадия его переводят в концентрированный раствор. Из него выделяют подкислением ванадат натрия, из которого в дальнейшем получают сильно концентрированный образец, с содержанием металла до 90%.
Затем этот высушенный осадок прокаливают в печи и восстанавливают ванадий до металлического состояния. В таком виде материал готов к использованию.
Ванадий - химический элемент, который находит достаточно широкое применение в промышленности. Особенно в машиностроении и выплавке сплавов из стали. Можно определить несколько основных областей использования металла.
- Текстильная промышленность.
- Стекловарение.
- Производство керамики и резины.
- Лакокрасочная промышленность.
- Получение и синтез химических веществ (сернокислое производство).
- Изготовление ядерных реакторов.
- Авиационное и кораблестроение, машиностроение.
Ванадий - очень важный легирующий компонент для получения легких, прочных, устойчивых к коррозии сплавов, в основном стали. Не зря его называют "автомобильным металлом".
Ванадий – неактивный элемент, в природе его соединения не реагируют на действие воздуха, воды, кислот или щелочей. Для его расплавления нужны очень высокие температуры. В организме ванадий тоже довольно инертен, хотя и вступает во взаимодействие с другими веществами.
Ванадий хорошо усваивается в присутствии цинка , фтора и селена , помогая всасыванию этих элементов. Ванадий считается токсичным веществом для человека, и эти его свойства могут усилиться, если одновременно с ним в организм попадают железо , магний , алюминий, аскорбиновая кислота (витамин С). А вот ослабить токсичность ванадия способны продукты с высоким содержанием хрома .
Важно! Ванадий снижает эффективность антикоагулянтов, поэтому нельзя принимать одновременно биодобавки с ванадием и препараты, снижающие свертываемость крови
Попадая в организм человека, ванадий депонируется в костях – это главное место накопления элемента, а также в мышечной и жировой тканях, причем в костях и зубах он помогает распределению кальциевых солей. В небольшом количестве ванадий есть в щитовидной железе и сердечной мышце, в легких, в селезенке и почках, где во взаимодействии с цирконием улучшает работу этих органов. Ванадий вступает во взаимодействие с калием и натрием , регулируя их баланс в тканях, при этом он помогает избавиться от отечностей.
Польза ванадия для здоровья пока плохо изучена. Известно на сегодня то, что этот элемент активно участвует в окислительных и восстановительных процессах на уровне клеток, нужен для дыхания и кроветворения, формирования костной ткани и роста зубов, для осуществления репродуктивных функций. Участие ванадия доказано в усилении зрения и стимулировании роста, в работе печени и почек, в укреплении сердечной мышцы и нервной системы.
Роль в возникновении и течение различных заболеваний
Роль ванадия в развитии заболеваний пока не имеет клинических подтверждений, но исследования показывают, что от содержания его в организме сильно зависит риск развития таких болезней как сахарный диабет, атеросклероз, нарушения работы почек и сердечно-сосудистой системы, снижение репродуктивных способностей.
Кроме этого, есть данные о том, что от уровня ванадия зависит проявление некоторых форм шизофрении.
Основные функции в организме

Воздействие ванадия на человеческий организм пока находится в стадии активного изучения и знания о нем еще недостаточны. Однако установлено, что соли ванадия способны имитировать эффект инсулина, регулируя углеводный обмен, так что ученые рассматривают возможность применения соединений ванадия при лечении сахарного диабета.
Еще одна ценная функция ванадия – он активизирует клетки иммунной системы фагоциты, которые поглощают чужеродные для организма частицы. К таким вредным частицам могут относиться вирусы, бактерии, токсические частички, отмершие или погибающие клетки. Активированные ванадием фагоциты очищают клетки и ткани, защищают организм от инфекций и воспалений.
Ванадий снижает выработку холестерина, поддерживает в здоровом состоянии сосуды мозга, тонизирует сердечную мышцу, понижает артериальное давление – все это важно для людей, страдающих заболеваниями сердечно-сосудистой системы.
Людям, стремящимся контролировать свою массу тела, будет интересно узнать о том, что ванадий необходим для усвоения жиров и углеводов, помогая в процессе их расщепления высвобождать энергию. Он нормализует обмен липидов и регулирует выработку жирных кислот.
Интересна функция ванадия как антиоксиданта: этот элемент активно вступает в окислительные реакции, предотвращая распространение и активизацию свободных радикалов, а также влияет на рост клеток, предупреждая их неконтролируемое деление – а значит и формирование злокачественных опухолей.
Среди других значимых функций ванадия в организме отметим следующие:
- вступает в комплексы с молекулами гемоглобина и стабилизирует их, предохраняя от окисления;
- выступает кофактором (стимулятором) ферментов, которые расщепляют и помогают усваивать белки;
- участвует в биосинтезе некоторых гормонов;
- улучшает усвоение кислорода тканями печени;
- контролирует работу нервной системы;
- участвует в формировании и росте костей скелета, зубов;
- предупреждает развитие атеросклероза.
Антиоксидантные и противомикробные свойства ванадия нашли применение в косметических средствах: например, экстракт василька, содержащий этот химический элемент, используют в косметике для ухода за чувствительной кожей вокруг глаз (он уменьшает отечность и улучшает тонус век), а также в средствах для проблемной кожи с элементами воспаленных высыпаний.
В каких продуктах содержится ванадий

Как сохранить ванадий в пище
Несмотря на химическую инертность, ванадий чувствителен к условиям хранения и обработки продуктов: он окисляется и переходит в плохо усвояемые формы при хранении на свету и в помещении с высокой влажностью, при длительной температурной обработке (отваривании, тушении), при размораживании продуктов. Оптимальный способ получить максимальное количество ванадия из продуктов – есть их в сыром виде (фрукты и овощи) либо отваривать в небольшом количестве воды или готовить на пару в течение непродолжительного времени.
Усвояемость минерала
Ванадий широко распространен в природе, больше всего этого вещества содержат морепродукты, грибы и злаки. Хорошо усваивается ванадий из меда в сотах и пчелиного маточного молочка.
Следует отметить, что организм способен усвоить только 1% от поступившего с едой элемента. Токсичность ванадия понижается, а усвоение улучшается в присутствии белковой пищи. Всасывание вещества происходит в тонком кишечнике, избыток выводится с мочой.
Сочетание с другими питательными веществами
В сочетании с другими питательными веществами ванадий выполняет транспортные функции – элемент помогает транспортировать белки, жиры и углеводы к клеткам мышц, способствуя их укреплению. Поэтому спортсменам во время активных тренировок рекомендуется увеличить ежедневное потребление продуктов с высоким содержанием ванадия – до 3 мг этого элемента в день.
Совет врача. Токсичность ванадия значительно снижается в присутствии хрома, поэтому полезно комбинировать в ежедневном меню продукты, содержащие оба этих элемента: например, морепродукты с рисом, грибы с брокколи, тунец со шпинатом
Суточные нормы
Ученые еще не определились с четкими нормами употребления ванадия, какое количество обязательно нужно получать с продуктами, и зависит ли оно от возраста либо других факторов. По рекомендациям ВОЗ (всемирная организация здоровья) от 2000 года суточная норма ванадия составляет от 6 до 63 мкг. Другие источники дают информацию о допустимом потреблении ванадия до 2 мг в день. Доза в 4 мг считается настолько токсичной, что может вызвать смертельный исход.
Что происходит при дефиците минерала

Последствия дефицита ванадия.
Примерное представление о том, как чувствует себя живой организм при дефиците ванадия, ученые имеют пока только на уровне лабораторных исследований. Недостаток этого вещества может ухудшить состояние костной и мышечной тканей, спровоцировать дефекты развития плода и выкидыши, ухудшить работу щитовидной железы, замедлить рост, стать причиной злокачественных новообразований.
Факторы, способствующие дефициту.
Причиной дефицита ванадия становится нарушение его всасывания в кишечнике или употребление биодобавок с веществами, которые ускоряют связывание и выведение этого элемента из организма, а также жесткие продолжительные монодиеты.
Как восполнить дефицит минерала.
При интенсивных тренировках спортсмены значительно расходуют энергию и нуждаются в дополнительном поступлении ванадия, участвующего в расщеплении глюкозы. Для пополнения запасов ванадия рекомендуется повысить содержание в меню соевых бобов, оливкового масла, укропа и редиса.
Избыток ванадия в организме
Некоторое время спортсмены считали, что биодобавки с содержанием ванадия могут способствовать в увеличении мышечной массы, однако проведенные исследования этого не подтвердили.
Избыток ванадия в организме – это более частая и конкретная тема обсуждения среди врачей, поскольку этот элемент может накопиться по следующим причинам:
- злоупотребление биодобавками с содержанием ванадия;
- вдыхание паров бензина, мазута, выхлопных газов, токсических выбросов при укладке асфальта;
- работа на производстве стекла;
- употребление воды, загрязненной отходами металлургических или нефтеперерабатывающих предприятий;
- употребление овощей, выросших на загрязненных промышленными отходами почвах.
Токсичность ванадия может стать причиной различных нарушений в организме. В условиях производства рабочие, имеющие дело с вдыханием частичек ванадия, часто страдают воспалительными заболеваниями глаз и дыхательных путей, различными болезнями кожи (экземы, дерматиты). Ванадий провоцирует скопление слизи в бронхах и развитие астмы, влияет на уменьшение количества лейкоцитов в крови и снижение иммунитета, способствует развитию анемии, нервных расстройств, обострениям заболеваний печени и почек.
Совет врача. При отравлении ванадием человек обычно ощущает тошноту и головную боль, он теряет аппетит и жалуется на диарею, депрессивное состояние, на языке может проступить зеленоватый налет, случается обезвоживание организма. Для нейтрализации токсического действия ванадия задействуют препараты хрома и аминокислоту ЭДТА (этилендиаминтетрауксусную кислоту)
Препараты, содержащие минерал
Из препаратов, содержащих ванадий, наиболее известен ванадил сульфат – биоактивная добавка, которую нередко принимают спортсмены при длительных и напряженных силовых тренировках. Эта добавка может быть рекомендована при избыточной массе тела и повышенном уровне холестерина, при некоторых нарушениях сердечной деятельности и сахарном диабете. Однако дозировку этого препарата и продолжительность приема обязательно должен контролировать врач.
Почему ванадий назвали металлом-хамелеоном, от чего зависит его изменение цвета и какими свойствами обладает этот металл, смотрите в видео ниже.