Методы лечения онкологии: консервативная и радикальная терапия рака. Выживаемость после онкологических операций
Читайте также
Клин группы онкобол:
1-а – заб подозр на злокач;
1-б – предопух заб;
2 – подлеж спец (радикальному) леч;
3 – практич здор после радик леч;
4 – распростран опух (палл или симптомат леч).
Комплексное леч - сочет двух разнонаправ методов (опер+химиотер)
Комбинир леч – несколько однонаправленных методов (лучев тер+медикамент)
Сочетанное леч – один метод с применением нескольких методик(лучев тер-дистантн+локальная,внутриполостная
Таргентная терап -цитостатическая тер – метод лекарственного воздействия яда на опухоль облад цитостатич дей: гормонотерапия и иммунотерапия-на опухолевой клетке есть АТ к развитию опухолевого роста, препараты блокируют рецепторы (тропные к АТ) с поверх клеток.
Радикал (от лат. radicalis, коренной) -направ на ликвид опух и предпол возмож полного выздор или достиж ремиссии. Ремиссия - это сост, когда опух ответила на леч или наход под контр. Различ полную ремиссию (все призн и симпт болезни отсутств) и частич (опух уменьш в разм, но не полн не исчез). Рем может продол от неск нед до неск лет. Полная ремиссия на протяж 5 лет рассм как выздоров больн.
Радикально лечение - ряд вмешательств, включая психосоциальную поддер, хирургию, лучевую и лекарст терапию.
Лекар терап как самостоя метод противооп леч примен в основ при злокач новооб лимфат и кроветв ткани
Комбинированный или комплексный метод использ в наиб объеме при леч злок нов яичников (75,7%), молочной железы (70,4%), тела матки (59,3%), гортани (39,5%), мочевого пузыря (36,0%).
Паллиатив направ на поддерж жизни и облег симп, вызыв раком, а не на излеч. Пал пом прим у пац с запущ стад бол и с низкой вер излеч. Счит, что пал леч может обесп облегч физич, психосоц и дух проб более чем у 90% пац с запущ стад рака.
Симптоматическое лечение болевого синдрома
В целях обезб испол анальгетики, режим, дозир и схема прим кот устанав врачом исходя из сост бол и выраже болевого синдрома. препарат может назнач по часам через определ пром врем, при этом последя доза приним или ввод тогда, когда предыд еще не закон свое дей. Таким обр, дости сост, когда пац не успев испыт боль между приемом препар.
ВОЗ «обезболивающая лестница», когда по мере ухудш сос пац мен анальгетик в сторону сильнодей или наркотич. Обычно начин ненаркот анальг (парацетамол, кеторол,), перех по мере прогрес симп на слабые (кодеин, трамадол), а затем и на силь опиаты (морфин). .
Симптоматическое лечение диспептичного синдрома
Критерии излеченности:
Отсутствие жалоб и признаков воспаления при гинекологическом исследовании;
Нормализация показателей крови;
Отрицательные результаты бактериоскопического и бактериологического исследований;
Восстановление нормального менструального цикла при его нарушении;
Восстановление фертильности.
Химиотерапия опухолей. Основные группы противоопухолевых препаратов. Показания и противопоказания к химиотерапии.
Хим - метод леч онко бол с использ лекар преп, тормозящ пролиферацию или необратимо повреждающих злокач клетки.
Противоопух эффект достиг: а) прямым дей (основной механизм)б) увеличением времени генерации клетокв) нанес раковой клетке поврежд , из-за кот она перес метастазг) стимуляцией иммунных и регулят реакций
Основные группы лек противоопух преп:
1. Алкилирующие преп : замеща атом водорода на алкилирующую группу; активны в фазе G2 и M:
Хлорэтиламины – произв бис- (бета-хлорэтил) амина (азотистые аналоги иприта)
Этиленимины
Производные нитрозометилмочевины
2. Антиметаболиты : явл антаг вещв, обеспеч норм метаб; актив в фазе G2 и S:
Антагонисты фолиевой кислоты
Аналоги пурина
Аналоги пиримидина
3. Антибиотики : взаимодей с ДНК, измен ее матричную активность в проц репликации и транскрипции; активны в фазе M:
Адриамицин (доксорубицин), блеомицин, актиномицин Д, брунеомицин, рубомицин и др.
4. Вещества растительного происхождения : нарушают митоз; активны в фазе M или G2:
Алкалоиды (винкристин, винбластин, колхамин и др.) – активны в фазе M
Эпиподофиллотоксины (этопозид, VP 16, VP 16-213) - активны в фазе G2
5. Производные платины : взаимод с ДНК; активны в фазе M:
Цисплатин, карбоплатин, платидиам
Противопоказания к химиотерапии : - нечувствительность опухоли- запущ процесс в соч с кахексией- декомпен хронич забол– берем- глубок стар и возраст менее 6 мес- налич метаст в ЦНС (относит противоп)- первич измен в крови (лейкоц<3000; тромбоц <100 000) + Невозмож оценить эффект леч, выяв и устр его осло. + Медл раст бессимпт опух, не подд излеч.
Показания
1.- лимфомы, нефробластома, саркома Юинга, ретинобластома, рабдомиосаркома у детей, лимфогранулематоз и некоторые лимфомы высокой степени злокачественности у взрослых (вероятность излечения достигает 50 % и более);
Герминогенные опухоли яичка - семиномы, несеминомы (вероятность излечения - 75 % и более);
Хориокарцинома у женщин (вероятность излечения -90 % и более);
Острые лейкозы у взрослых, рак яичников (вероятность излечения - 15-20 %).
2. Существ продл жизни (при небольшой вер излеч)
3. Уменьш выражен симпт при диссеминир формах зло опух.
4. Лечение бессимптомных опух:
При выявл агрессив опух, чувствит к лекар леч;
5. Уменьш объема планир хир вмеш (неоадъюв химиот).
Методики химиотерапии:
1. По целевому назначению: самостоят метод и дополн метод (адъювантный или неоадъювантный)
2. По режиму: монохимиотерапия, полихимиотерапия, интенсивная или высокодозная
3. По способу применения: системная, локальная, регионарная
Варианты полихимиотерапии:
а) цитостатик + цитостатик б) цитостатик + гормон в) цитостатик + антидот
Принципы полихимиотерапии:
1. Цитотоксический (прим преп, различающиеся механ дей)
2. Токсикологический (преп с разной токсичностью)
3. Биохимический (прим вещ, вызыв различные биолог наруш)
4. Цитокинетический (необход синхронизации клеток по циклу)
ВИДЫ ЛЕК ТЕР
1. Первичная хим местно-распростр неоперабельного и метастатического проц. Выделяют излечивающую и паллиативную хим. Пал при выяв отдал метаст с целью не излеч, а продл жизни и улучш ее кач.
2. Адъювантная хим доп метод леч, назнач после вып радик или циторедуктивной опер или лучевой терапии, т.е. при отсутст остаточной опухоли и отдал метаст.
3. Неоадъювантная хим перед вып план опер вмеш или лучевой терапии с целью умен объемов первич опухоли и ее рег мет.
Хирургические методы - это в основном методы локального лечения, основанного преимущественно на ножевом или электрохирургическом иссечении первичного очага злокачественной опухоли. К хирургическим методам относят также замораживание опухолевой ткани, криохирургию и разрушение опухоли лазерным лучом.
Несмотря на различные виды механического и физического воздействия, все эти методы преследуют прежде всего цель непосредственного удаления или разрушения опухоли, исходя из представления, что первоначально она имеет локальный характер. Иными словами, хирургические методы наиболее эффективны при лечении начальных стадий развития опухоли.
В настоящее время опухоли почти всех локализаций могут быть подвергнуты хирургическому лечению. Широко используется хирургия рака пищевода, легкого, гортани, щитовидной железы, трахеи, молочной железы, желудка, толстой кишки, почки, мочевого пузыря, внутренних органов женской половой сферы. Кроме того, оперативное лечение является ведущим при опухолях мягких тканей и забрюшинного пространства, саркомах опорно-двигательного аппарата. Среди различных методов лечения злокачественных новообразований (оперативных, лучевых, химиотерапевтических) доля хирургических методов составляет 40-50% (без учета паллиативных и пробных операций).
При обсуждении плана лечения каждого онкологического больного, которое должно обязательно осуществляться группой специалистов-онкологов (хирург, радиолог, химиотерапевт) определяют показания к применению того метода лечения, который может оказаться наиболее эффективным в данном конкретном случае. При этом необходимо учитывать возраст больного, наличие сопутствующих заболеваний, локализацию злокачественной опухоли, степень ее распространенности, темпы роста и морфологическую структуру опухоли. Только при объективном обсуждении этих данных может быть окончательно решен вопрос о целесообразности применения хирургического метода лечения.
Противопоказания к хирургическому лечению рака
Противопоказанием к радикальному хирургическому лечению служит генерализация опухолевого процесса - развитие диссеминации и появление отдаленных метастазов, неудалимых при оперативном вмешательстве. Как правило, такая генерализация наблюдается при низкодифференцированных формах рака, протекающих биологически крайне агрессивно.
Противопоказанием к операции может явиться также общее тяжелое состояние больного, обусловленное старческим возрастом и наличием некомпенсированных сопутствующих хронических заболеваний сердца, легких, печени, почек. Однако после тщательной подготовки таких больных в стационарных условиях общее состояние и функциональные показатели могут существенно улучшиться, свидетельствуя о наступившей компенсации. В таких случаях, особенно при локализованном опухолевом процессе, следует повторно обсудить вопрос о возможности хирургического лечения.
Показания к хирургическому лечению рака
Хирургическое лечение показано и, как свидетельствует накопленный опыт, оно оказывается наиболее эффективным при наличии следующих условий.
1. Локализация злокачественной опухоли в пределах части пораженного органа (доли, сегмента, сектора), когда опухоль не распространяется за покрывающую орган серозную оболочку или капсулу. При прорастании последних и развитии метастазов в регионарных лимфатических узлах хирургический метод также применим, однако отдаленные результаты в таких случаях значительно ухудшаются.
2. Экзофитный характер опухоли, когда хорошо выражены ее границы и опухолевый узел четко ограничен от окружающей ткани. Если опухоль представляет собой инфильтрат без четких границ, то это значительно снижает возможности радикального иссечения, поскольку очень трудно определить истинное распространение опухоли по органу. В подобных случаях при гистологическом исследовании удаленного препарата по линии операционного разреза нередко обнаруживают опухолевые клетки.
3. Сохранение высокой степени клеточной дифференцировки опухоли, т. е. наличие картины структурной зрелости, когда ткань опухоли по сравнению с нормальной, хотя и является менее совершенной, но все же в определенной мере сохраняет ее морфологические и функциональные признаки. Напротив, прогноз резко ухудшается при хирургическом лечении злокачественных опухолей низкой степени зрелости, с потерей клеточной дифференцировки.
4. Медленные темпы прогрессирования опухоли, что определяется на основании изучения анамнестических данных, результатов диспансерного наблюдения, путем сопоставления флюорограмм и рентгенограмм, произведенных в предыдущие годы при профилактической флюорографии, оформлении на санаторно-курортное лечение, поступлении на работу и т. д. Имеется определенная зависимость между клиническим течением и морфологической характеристикой опухоли. При длительном, торпидном развитии заболевания, иногда исчисляемом многими месяцами и даже годами, существует большая вероятность относительно высокой степени зрелости злокачественной опухоли. Так, например, клиническое течение высокодифференцированных форм папиллярного рака щитовидной железы и злокачественных карциноидов кишечника может исчисляться несколькими годами, в то время как больные с низкодифференцированными формами рака щитовидной железы, желудка, кишечника, молочной железы, как правило, имеют короткий анамнез и клинически эти опухоли протекают крайне агрессивно. С другой стороны, клиническое течение злокачественных новообразований обусловлено степенью не только зрелости клеточных элементов опухоли, но и реактивности организма, что имеет весьма важное значение при выборе хирургического метода лечения.
Обязательным условием хирургического вмешательства при злокачественных опухолях является соблюдение принципов онкологического радикализма, предусматривающих знание биологических особенностей распространения опухоли в пределах пораженного органа, возможностей перехода на соседние органы и ткани, а также четкого представления о путях метастазирования по лимфатическим коллекторам.
Ошибки при хирургических операциях
Опыт показывает, что хирурги, не обладающие специальной подготовкой для оперирования онкологических больных и не имеющие достаточных знаний о клинико-биологических закономерностях развития рака, допускают ряд серьезных ошибок, роковым образом отражающихся на дальнейшей судьбе пациента.
Довольно часто при меланоме кожи производят амбулаторное, нерадикальное, косметическое удаление опухоли, ошибочно принимаемой за «родинку», «пигментное пятно» и др. Иногда прибегают к биопсии такого образования, что является совершенно недопустимым. При раке молочной железы, мягких тканей конечностей и туловища иногда ограничиваются энуклеацией опухолевых узлов, не осуществляя при этом срочного гистологического исследования удаленной опухолевой ткани, хотя в подобных случаях оно должно выполняться обязательно. Распространенной ошибкой при раке желудка, толстой кишки, гортани, щитовидной железы, шейки матки является выполнение операций не отвечающих в полной мере принципам онкологической хирургии. В частности, не всегда достаточно широко удаляют окружающую орган клетчатку с лимфатическими узлами. Даже в хорошо оснащенных хирургических клиниках зачастую не производят гистологического контроля с помощью срочной биопсии при резекции пораженного опухолью органа. Между тем в таких случаях при плановом гистологическом исследовании могут быть обнаружены опухолевые клетки по линии операционного разреза. Это указывает на то, что объем операции был определен неправильно и лечение оказалось нерадикальным,
Оперативное вмешательство, производимое с соблюдением онкологического радикализма, обязательно предусматривает четкое выполнение следующих принципиальных установок.
1. Широкое иссечение органа или тканей, из которых исходит злокачественная опухоль. Учитывая особенности распространения опухоли, наиболее радикальным следует считать тотальное или субтотальное удаление пораженного органа, например, при раке молочной железы - полное ее удаление, при раке желудка - тотальную или субтотальную гастроэктомию, при раке легкого - пневмонэктомию. Вместе с тем наличие в ряде случаев ограниченного процесса позволяет считать возможным выполнение экономных операций, при которых удаляют только пораженную долю, сектор или сегмент органа. Например, при небольшом по размеру раке легкого может быть произведена лобэктомия, при начальном раке щитовидной железы - гемитиреоидэктомия с удалением перешейка, при ограниченном раке гортани - горизонтальная или вертикальная резекция органа. Выполнение такого рода операций, иногда в комбинации с лучевым лечением или химиотерапией, не снижает степени радикализма и вместе с тем является более выгодным в функциональном отношении.
2. Удаление регионарных лимфатических узлов, являющихся зоной возможного метастазирования или уже пораженных метастазами. Такими регионарными лимфатическими коллекторами для молочной железы являются подкрыльцовые и подключичные лимфатические узлы. Отток лимфы из желудка осуществляется прежде всего в лимфатические узлы большого и малого сальника. При раке шейки и тела матки лимфогенное метастазирование на первом этапе ограничивается бассейном подвздошных и обтурационных ямок. С целью более радикального иссечения лимфатических сосудов и узлов их удаляют с окружающей жировой клетчаткой в пределах включающего их фасциального футляра.
3. Удаление пораженного органа, регионарного лимфатического коллектора и при необходимости окружающих тканей производят, как правило, единым блоком, так как такой характер оперативного вмешательства повышает степень радикализма в связи с тем, что при этом не обнажается поверхность опухоли, не пересекаются лимфатические пути и, следовательно, снижается возможность обсеменения операционного поля опухолевыми клетками. С целью уменьшения так называемой манипуляционной диссеминации техника оперирования должна быть атравматичной, исключающей непосредственный контакт рук оперирующего хирурга и хирургического инструментария с опухолью. Все это создает условия для абластического оперирования, подобно тому, как асептика предусматривает профилактические мероприятия с целью избежать инфекционного загрязнения операционной раны.
Выживаемость после онкологических операций
В настоящее время разработаны типовые операции при раке различных локализаций, предусматривающие наибольшую степень онкологического радикализма и высокую эффективность отдаленных результатов. Так, радикальная мастэктомия при локализованных формах рака молочной железы позволяет получить стойкое пятилетнее выздоровление у 70-85% больных. Расширенная экстирпация матки при раке этого органа в комбинации с лучевым лечением обеспечивает пятилетнее излечение у 74-82% больных, расширенная ларингэктомия при раке гортани (в плане комбинированного лечения) - у 60-70%, тотальная и субтотальная тиреоидэктомия при высокодифференцированных и локализованных формах рака щитовидной железы - у 80-84%. Несколько хуже результаты хирургического лечения рака желудка - пятилетняя выживаемость составляет 35-40%. Однако после радикальных резекций желудка при раке прорастающем только слизистую оболочку и мышечный слой, пятилетняя выживаемость повышается до 70%. Экстирпация прямой кишки при различных формах рака в целом обеспечивает пятилетнюю выживаемость в 35-40%. После пневмонэктомии и лобэктомии по поводу всех форм рака легкого 5 лет живет 25-30% оперированных. Нет сомнения в том, что при улучшении условий для более раннего выявления злокачественных опухолей и своевременного выполнения радикальных операций можно было бы значительно улучшить результаты хирургического лечения.
Объем хирургического вмешательства
Однако в настоящее время хирургические операции приходится зачастую выполнять в менее благоприятных условиях, когда опухолевый процесс уже имеет значительную распространенность. В этих условиях особое значение приобретает выбор оптимального варианта объема хирургического вмешательства. На протяжении последних десятилетий велась активная дискуссия по этому вопросу. В основном обсуждались две точки зрения. Согласно первой, объем оперативного вмешательства определяли формулой: «маленькая опухоль - большая операция, большая опухоль - маленькая операция», т.е. при большом распространении опухоли бесполезно рассчитывать на радикализм, даже расширяя границы оперативного вмешательства. Операцию в таких случаях следует выполнять как паллиативную или пробную. Согласно другой точке зрения, «малая опухоль требует большой операции, а большая опухоль - еще большей». Сторонники этой точки зрения стоят за расширение объема хирургического вмешательства даже при прорастании опухоли в соседние органы и ткани и наличии отдаленных, но удалимых метастазов. Они предлагают выполнять расширенные или комбинированные оперативные вмешательства. Серьезными аргументами в пользу таких больших по объему операций являются следующие данные. Проведенные научные исследования показали, что целому ряду больных отказывают в радикальном лечении из-за ошибочного завышения распространенности опухолевого процесса. Так, было установлено, что у 15% больных после ранее произведенных пробных торакотомий по поводу якобы неоперабельного рака легкого удалось при повторном вмешательстве выполнить радикальные операции, более чем 20% больных раком желудка также ошибочно были признаны неоперабельными во время лапаротомий. Эти больные были радикально оперированы более опытными хирургами-онкологами.
По данным патологоанатомических исследований умерших в отдаленные сроки после типичных по объему, так называемых радикальных операций по поводу рака легкого, почти в половине случаев обнаруживают рецидивы и метастазы вследствие недостаточно адекватного объема операции. Таким образом, разумно расширяя границы оперативного вмешательства даже при распространенных формах рака, можно реально оказывать помощь еще большей группе больных. Все более широкое использование комбинированного лечения, дополняющего оперативное вмешательство применением лучистой энергии или химиотерапии, позволяет улучшать показатели стойкого выздоровления.
Крайнюю позицию занимают хирурги, выполняющие так называемые сверхрадикальные операции при далеко зашедших формах рака внутренних органов. Например, при распространенном раке желудка выполняют тотальную гастроэктомию, резекцию толстой кишки, части левой доли печени, части поджелудочной железы, удаление селезенки и доли легкого, где имеется метастаз. При далеко зашедшем раке матки производят так называемую эвисцерацию малого таза - удаление матки, прямой кишки, мочевого пузыря с пересадкой мочеточников в сигмовидную кишку. Такие же обширные операции выполняют при запущенном раке языка и дна полости рта - удаление языка, резекцию нижней челюсти, удаление мышц дна полости рта, резекцию глотки, иссечение гортани и метастазов в лимфатических узлах шеи.
Иногда такие сверхрадикальные операции являются калечащими и тяжело инвалидизируют больного. Таковы, например, вычленение половины плечевого пояса или нижней конечности вместе с половиной костей большого таза. Физиологическая и психологическая реабилитация больных, перенесших такие операции, является очень сложной задачей. Изучение отдаленных результатов после таких сверхрадикальных операций заставляет очень сдержанно относиться к их выполнению. Однако в ряде случаев они представляются оправданными и могут предприниматься хорошо подготовленными хирургами при наличии необходимых условий (сложная аппаратура, специалисты по анестезиологии и реабилитации).
Паллиативные операции
Наряду с выполнением радикальных операций по поводу рака производят так называемые паллиативные операции. Пожалуй, ни в одной области хирургии не выполняется так много паллиативных операций, как в онкологии, в связи с все еще большим числом больных, выявляемых в поздних стадиях заболевания.
Паллиативные операции можно условно разделить на две категории. В ряде случаев их выполняют по неотложным показаниям при непосредственной угрозе жизни больного в связи с осложненным течением заболевания. Так, например, приходится накладывать трахеостому при стенозировании гортани раковой опухолью; перевязывать сонную артерию при кровотечении из распадающейся опухоли полости носа и придаточных пазух; при раке пищевода формировать гастростому для искусственного кормления истощенного больного, а при неудалимой опухоли, стенозирующий выходной отдел желудка, - гастроэнтероанастомоз; прибегать к наложению противоестественного заднего прохода при кишечной непроходимости, вызванной опухолевой обтурацией. В перечисленных операциях опухоль не удаляют, однако создают для нее условия относительного покоя; в результате уменьшается интоксикация, кровопотеря и наступает улучшение состояния больного, которое может продолжаться длительное время, исчисляемое месяцами, а иногда и годами. К этой категории операций можно отнести вынужденную резекцию желудка в связи с обильным кровотечением из распадающейся опухоли, резекцию толстой кишки по поводу обтурационной непроходимости, лобэктомию или пневмонэктомию при развитии абсцесса на фоне опухоли легкого или угрозе кровотечения при неудалимых отдаленных метастазах.
Другого типа паллиативные операции выполняют в плановом порядке с целью удаления основного массива опухоли, чтобы впоследствии воздействовать на остаток опухоли или ее метастазы с помощью лучистой энергии или противоопухолевых препаратов. Так поступают, в частности, при распространенных формах папиллярного рака яичников и семиноме с метастазами в легкое, распадающейся большой опухоли молочной железы.
В целом ряде случаев при выполнении так называемых радикальных операций обнаруживают значительно большую распространенность опухолевого процесса, чем это казалось в начале или в процессе вмешательства. Такого рода операции по существу тоже являются паллиативными и требуют в последующем дополнительного лечебного воздействия. Следует отметить, что число таких операций, по-видимому, неуклонно возрастает, так как расширяются возможности для их технического выполнения и увеличивается арсенал дополнительных средств воздействия на остатки опухоли. Условно к паллиативным операциям можно отнести овариэктомию, адреналэктомию или орхиэктомию, выполняемые в плане комплексного лечения уже генерализованного опухолевого процесса при некоторых гормонально-зависимых формах рака.
Диагностические операции при раке
Особое место в хирургическом лечении онкологических больных занимают диагностические, или эксплоративные, операции. Как правило, они являются заключительным этапом диагностики, когда в большинстве случаев окончательно устанавливают характер опухоли и степень ее распространенности.
По существу почти каждая операция, производимая по поводу злокачественной опухоли, начинается с ревизии, во время которой наряду с осмотром и пальпацией следует использовать методы морфологической диагностики (биопсия, диагностическая пункция). Результаты именно этих методов позволяют наиболее объективно обосновать отказ от радикальной операции при гистологическом подтверждении отдаленных метастазов и решить вопрос о целесообразности применения лекарственного или лучевого лечения с паллиативной целью. Для правильного планирования лучевого лечения (определения границ полей облучения) во время пробных операций целесообразно маркировать границы опухоли.
Электрохирургические и криохирургические методы лечения рака
Электрохирургический метод лечения нередко применяют с целью повышения абластичности вмешательства при инфильтративных формах злокачественных опухолей, где границы опухолевого роста определяются нечетко (рак языка и верхней челюсти, саркомы мягких тканей, инфильтративные формы рака молочной железы). Широко используют электрокоагуляцию полипов и ворсинчатых опухолей прямой кишки, полипов желудка и ободочной кишки.
Криохирургия, или криодеструкция (разрушение, опухоли с помощью замораживания), нашла применение при злокачественных опухолях кожи волосистой части головы и шеи, красной каймы губы, полости рта и полости носа, слухового прохода. Самый высокий процент излечения (до 96%) получен при злокачественных новообразованиях кожи лица, волосистой части головы и нижней губы. Криогенный метод лечения может быть, использован в амбулаторных условиях, так как отличается простотой методики, отсутствием выраженных реакций и осложнений.
Условно радикальным называют лечение, требующее длительной реабилитации и имеющее достаточно высокую эффективность. К таким методам относят:
Лучевую терапию . Радиационное облучение применяют исключительно в качестве дополнения к операции. Во время процедуры уничтожаются раковые клетки непосредственно на месте опухоли. Главная задача такой терапии - исключить рецидивы после операции.
В зависимости от цели, лучевая терапия при раке молочной железы бывает
- · Радикальная, при которой достигается полная резорбция опухоли и излечение больного.
- · Паллиативная применяется при распространенном процессе, когда добиться полного излечения невозможно. Под действием лечения можно лишь продлить жизнь больного, уменьшив страдания.
- · Симптоматическое облучение применяется для устранения наиболее тяжелых симптомов рака, в первую очередь, болевого синдрома, который не поддается купированию наркотическими обезболивающими препаратами.
Облучаемые области при проведении радиотерапии
В зависимости от цели, облучению могут подвергаться следующие зоны:
- · Молочная железа (пораженная сторона)
- · Регионарные лимфатические узлы (на стороне поражения)
- · Надключичные и подключичные лимфоузлы с захватом кивательной (грудинно-ключично-сосцевидной) мышцы
Будучи генетически разнородным заболеванием, имеющим множество форм клинического течения, рак груди считается одним из наиболее сложных заболеваний при выборе рационального лечения, когда приходится учитывать множество факторов, каждый из которых может быть решающим не только в прогнозе заболевания, но и в судьбе пациентки.
Лучевая терапия при раке груди - часть комплексного лечения, и в качестве средства монотерапии в настоящее время не используется. Она может сочетаться с другими методами (операция, гормонотерапия, химиотерапия). С уменьшением объема хирургического лечения при органосохраняющих операциях роль лучевой терапии возрастает.
Выбор схемы комплексного лечения определяется следующими факторами:
- · Распространенностью ракового процесса,
- · Гистологическим строением новообразования,
- · Характера роста опухоли.
Химиотерапия. Подразумевает под собой прием химических препаратов, оказывающих негативное воздействие на раковые клетки. Это яды и токсины, которые имеют побочное действие и вместе с клетками опухоли уничтожают и клетки крови и тканей организма, которые могут быть чувствительны к тому или иному препарату. Выпускаются химиопрепараты в форме таблеток или растворов для внутривенного переливания. Химиотерапия проводится периодически, в несколько этапов. Применяются и до, и после операции, иногда заменяют собой хирургическое вмешательство. После химиотерапии организм может восстановиться в течение нескольких месяцев.
Разделяют несколько видов химиотерапии при раке груди:
- · адъювантную (неадъювантную);
- · лечебную.
Адъювантную (профилактическую) химиотерапию проводят после хирургического вмешательства на грудной железе для воздействия на скрытые очаги опухоли в других органах. Неадъювантная химиотерапия назначается до операции; она позволяет узнать, чувствительны ли новообразования к воздействию препаратами. Минусы неадъювантной: затягивание с оперативным вмешательством, сложности с определением гистологического типа новообразования.
Лечебная химиотерапия при раке груди проводится ещё до оперативного вмешательства с целью уменьшения размера локализированного новообразования. В отдельных случаях такая мера позволяет вместо мастэктомии (полного удаления молочной железы) обойтись всего лишь люмпэктомией (удалением поражённой части молочной железы и небольшого объёма здорового участка). Также этот вид химиотерапии проводят для уменьшения отдалённых метастазов.
Таргетная терапия. Направлена на блокировку гена HER2, если его активность вызывает рост раковой опухоли. Препараты позволяют замедлить рост опухоли или предотвратить рецидив после операции.
Иммунотерапия. Метод задействует собственные защитные механизмы организма пациента. Стимулируя иммунитет, препараты помогают в ликвидации раковых клеток. Сама по себе иммунотерапия недостаточно эффективна, поэтому ее используют только в сочетании с другими методами (например, с химическими препаратами.)
Онкология молочной железы, лечение которой было проведено только условно радикальными методами, чаще всего возникает снова, даже если результат оказался удачным. На данный момент эти методы используют в большинстве случаев как вспомогательные. Также с помощью химио- и лучевой терапии можно задержать рост метастаз.
При раке головки общепризнанной радикальной операцией является панкреатодуоденальная резекция, впервые успешно выполненная W. Kausch в 1909 г. Отечественные и зарубежные хирурги (В. Н. Шамов, 1955; А.
Н. Велико-рецкий, 1959; В. В. Виноградов, 1959; А. А. Шалимов, 1970;Н. С. Макоха, 1964; В. И, Ршчиашвили, 1970; А. В. Смирнов, 1969; Child, 1966; Brunschwig, 1942; Cattel, 1953; Salmon, 1966;
Smith, 1965, и др.) внесли большой вклад в разработку этого вмешательства. Из отечественных хирургов наибольший опыт панкреатодуоденальных резекций в настоящее время имеет А. А. Шалимов, который сообщил на XXIV Конгрессе Международного общества хирургов (1971) о 103 операциях, Н. С. Макоха произвел 85 операций (1969), А. В. Смирнов - 70 (1969), Е. С. Футорян и Б. М. Шубин (1977) -39. По данным зарубежных авторов (Warren et al., 1962), в клинике Лехи за 20 лет произведено 218 панкреатодуоденальных резекций. Monge с соавт. (1964) сообщают о 239 операциях в клинике Мейо за 22 года.
Несмотря на накопленный опыт, панкреатодуоденальная резекция широкого распространения не получила. Это вызвано целым рядом причин. Больные поступают в хирургические отделения в большинстве случаев с распространенным опухолевым процессом, в связи с чем резектабельность при раке поджелудочной железы низка и составляет по данным А. А. Шалимова (1970) 9,4%, В. И. Кочиашвгош (1970) - 10,1%; С. М. Микир-тумова (1963) - 4,9%, по данным клиники Мейо (Monge et al., 1964) резектабельность при раке головки поджелудочной железы составила 10%. У отдельных авторов этот показатель выше: у Salembier (1970) - 13%, Doutre с соавт. (1970) - 25%,yElias (1969)-27%.
Панкреатодуоденальная резекция - тяжелое травматическое вмешательство, сопровождающееся высокой послеоперационной летальностью. Enters с соавт. (1961) приводят материалы различных исследователей. По их данным, летальность составляет от 20 до 80%. На 169 операций, произведенных отечественными хирургами к 1968 г. (исключая наблюдения А. А. Шалимова), послеоперационная летальность составила 50%. Лучшие показатели лишь у единичных авторов: Sinith (1965) -7,7%, а из 35 больных, оперированных Warren с соавт. (1968), умер
1 больной.
Пятилетняя выживаемость после данкреатодуоденальной резекции при раке поджелудочной железы очень низкая: от 0 до 10-12%; средняя продолжительность жизни 9-15 мес (А. Н. Великорецкий, 1959; А. В. Смирнов, 1961; Fayos, Lainpe, 1967; Bowden, Pack, 1969, и др.). По данным ОНЦ АМН СССР, резектабельность при раке поджелудочной железы составила 5,4%. В МНИОИ им. П. А. Герцена резектабельность оказалась равной 7,4%, послеоперационная летальность - 48%; средняя продолжительность жизни составила 13 мес. Это объясняет, почему наряду с пропагандой панкреатодуоденальной резекции ее сторонниками высказывается сдержанное или негативное отношение к этому вмешательству. Радикальная или паллиативная операция при раке поджелудочной железы - вопрос, обсуждение которого не сходит со страниц медицинской прессы.
Успехи анестезиологии, получение антибиотиков широкого спектра действия, антиферментная терапия для профилактики и лечения послеоперационного панкреатита, применение эффективных дезинтоксикационных средств и др.
Дают основание к дальнейшей разработке панкреатодуоденальной резекции.
Операция состоит из двух этапов:
первый включает мобилизацию и удаление препарата,
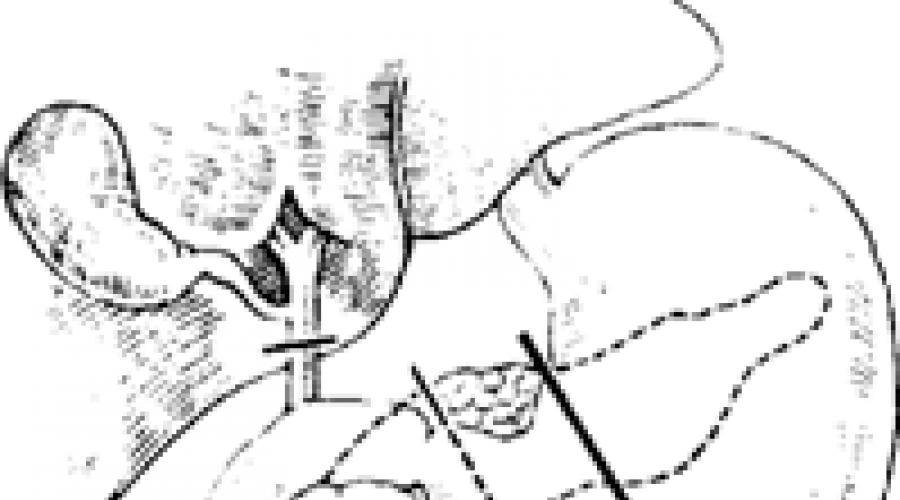
второй - заключается в восстановлении проходимости желудочно-кишечного тракта и желчных путей. Методика мобилизации достаточно хорошо разработана, близка к стандартизации и подробно представлена в значительном числе монографий и атласов (В. В. Виноградов, 1959; А. А. Шалимов, 1970; В. И. Кочиашвили, 1970). Производится резекция головки поджелудочной железы, общего желчного протока, дпстального отдела желудка и двенадцатиперстной кишки (рис. 120). А. А. Шалимов (1970) в зависимости от степени распространенности процесса применяет два варианта операции:
I - с резекцией двенадцатиперстной кишки до мезентериальных сосудов;
II - с полным удалением двенадцатиперстной кишки после высвобождения ее дистального отрезка из-под мезентериальных сосудов.
Восстановительный этап операции очень вариабелен. Предлагаемые способы реконструкции (более 70) направлены на предупреждение осложнений (холангита, панкреатита и др.).
Ключевым моментом панкреатодуоденальной резекции является обработка культи железы. Метод глухого ушивания культи, разработанный Whipple в 1935 г., не нашел широкого распространения. Более физиологично создание панкреатодигестив-ного соустья. По мнению Е. С, Футоряна и Б. М. Шубина (1975), при определенных показаниях оправдано применение трех вариантов (рис. 121).
1. Наиболее распространенный метод - наложение панкреатоеюноанастомоза. Реконструктивный этап осуществляется путем последовательного (сверху вниз) создания панкреатоди-гестивного, билиодигестивного и желудочно-кишечного соустий. В МНИОИ им. П. А. Герцена применяется методика разобщения первых двух соустий путем прошивания петли кишки между ними с помощью аппарата УКЛ-60. Такая методика предотвращает забрасывание желчи в протоки поджелудочной железы и панкреатического сока в желчные пути, что служит профилактикой послеоперационного холангита и панкреатита.
2. Глухое ушивание культи показано при выраженном вторичном панкреатите с образованием некротических бляшек, когда наложение соустья с кишкой особенно рискованно. В этих случаях целесообразно произвести субтотальную резекцию железы в надежде на малую внешнесекреторную функцию небольшой культи (это уменьшает опасность развития послеоперационных осложнений).
3. Наложение панкреатогастроанастомоза показано при благоприятных анатомических условиях и широкой культе панкреатического протока. При создании соустья оправдано применение временного наружного отведения панкреатического сока.
При раке тела и хвоста железы производится резекция дистального отдела железы обычно вместе с селезенкой. Эти операции крайне редки, так как больные поступают, как правило, в запущенной стадии заболевания. В МНИОИ им. П. А. Герцена метастазы выявлены при этой локализации рака в 96% случаев.

Рис. 120. Границы панкреатодуоденальной резекции.
Рис. 121. Варианты реконструктивного этапа панкреатодуоденальной резекции.
Еще по теме Радикальное лечение.:
- 275. Диагностика и лечение рецидива РПЖ после радикального лечения.
- 204. Общая стратегия при лечении IV стадии заболевания и рецидивов и метастазов после ранее проведенного радикального лечения
- КОМБИНИРОВАННОЕ ОРГАНОСОХРАНЯЮЩЕЕ ЛЕЧЕНИЕ МЫШЕЧНО-ИНВАЗИВНОГО РАКА МОЧЕВОГО ПУЗЫРЯ ПРИ ОТКАЗЕ ОТ РАДИКАЛЬНОЙ ЦИСТЭКТОМИИ
Лечение рака осуществляется с помощью стандартных хирургических вмешательств под названием радикальных операций. Показанием к радикальным операциям есть результаты дооперационногo клиническогo, инструментальногo, лабораторного обследования больного и данные ревизии патологического процесса во время операции, которые удостоверяют отсутствие отдаленных метастазов и прорастание в соседние анатомические структуры.
Лечение рака возможно с помощью типичных, комбинированных и расширенных радикальных операций. Хирургам часто приходится оперировать больных,у которых опухолевый процесс вышел за пределы opгaнa и перешел на другие анатомические cгруктуры. В таких случаях, при отсутствии отдаленных метастазов, возникает необходимость дополнительного удаления или частичной резекции других opгaнов и тканей. Такие paдикальные операции называют комбинированными. Например удаление желудка в сочетании с резекцией хвоста поджелудочной железы при раке желудка.
К расширенным хирургическим вмешательствам относят те, которые сопровождаются удалением лимфатических узлов. Кроме тогo, разработаны так называемые суперрадикальные операции, когда вместе с opгaнoм, в котором расположена первичная опухоль, полностью удаляют несколько соседних opгaнов (в связи с их опухолевым поражением) или значительную часть тела. Примером такой операции может быть ексентерация таза с удалением прямой кишки, гениталий, мочевого пузыря. Такую операцию иногда выполняют при местно распространенном раке прямой кишки или раке матки, опять же, при условии отсутствия отдаленных метастазов. Уместность исполнения суперрадикальных операций для лечения рака остается дискутабельной.
Достижением онкохирургии в последние десятилетия является внедрение в практику оргaносохраняющих и реконструктивных операций. Это связано с успехами в ранней диагностике опухолевого процесса.
При органосохраняющих операциях объем хирургическогo вмешательства уменьшается до относительно локального удаления первичной опухоли в пределах здоровых тканей с устранением или даже оставлением регионарных лимфатических узлов. К таким операциям принадлежит, например, радикальная секторальная резекция молочной железы.
С целью сохранения качества жизни онкологических больных, ликвидации значительных косметических дефектов после радикальных хирургических вмешательств применяют реконструктивные операции - восстановление молочной железы, ликвидация значительных косметических дефектов в области головы и шеи и т.д..
Отдельным больным с определенными видами рака, при которых peгионарные лимфатические узлы доступны для исследования, возможно ограничиться локальным удалением опухоли в пределах здоровых тканей. Рeгионарные лимфатические узлы как иммунный opгaн оставляют. За такими больными осуществляется наблюдение и только при клинической манифестаиии метастазов в регионарных лимфатических узлах прибегают к их удалению.