Гальванические элементы - устройство, принцип работы, виды и основные характеристики. Гальванические элементы
Читайте также
В электротехнике с давних пор используются различные гальванические элементы. Можно сказать, что именно они стояли у истоков научных исследований такого явления, как электричество. Чтобы разобраться в природе электрического тока, необходимо, прежде всего, уяснить, что такое гальванический элемент.
Характеристики
Каждый гальванический элемент является химическим источником тока. Вырабатывание электрической энергии здесь происходит в результате окислительно-восстановительных реакций. Получается прямое преобразование химической энергии в электрический ток.
Стандартный гальванический элемент включает в себя разнородные электроды, в одном из которых содержится окислитель, а в другом - восстановитель. В процессе реакции, оба они вступают в контакт с электролитом. По сроку действия, элементы могут быть одноразовыми, многоразовыми и непрерывного действия. Наибольшее распространение получила обыкновенная электрическая , использующаяся во множестве современных устройств.
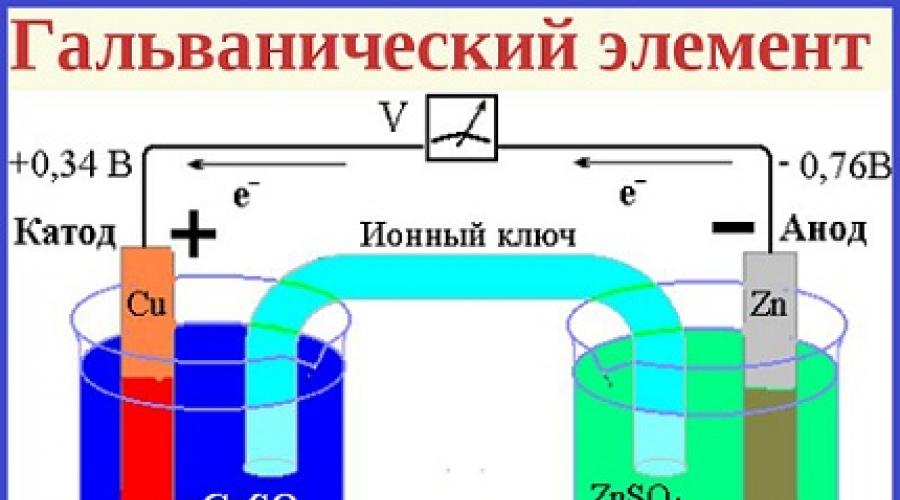
Принцип работы
В состав элемента входят два металлических электрода, разнородных по своим физическим свойствам. Как правило, они размещаются в электролите, представляющем собой вязкую или жидкую среду. Когда электроды соединяются с помощью внешней электрической цепи, начинается течение химической реакции. В это время начинается движение электронов от одного электрода к другому, благодаря чему и появляется электрический .

Отрицательный полюс элемента состоит из электрода, теряющего свои электроны, его материалов служат литий или цинк. В процессе реакции, он исполняет роль восстановителя. Соответственно, другой электрод является окислителем и выполняет функцию положительного полюса. Материалом для него служат окислы магния, реже применяется ртуть или соли металлов.
Сам электролит, где находятся электроды, является веществом, не способным в обычных условиях пропускать электрический ток. Когда электрическая цепь становится замкнутой, начинается распад вещества на ионы, благодаря чему появляется электропроводность. Материалами для электролитов, чаще всего, служат растворенные или расплавленные кислоты, а также соли калия и натрия.
Вся конструкция гальванического элемента размещается в металлической емкости. Электроды выполнены в виде металлических сеточек, куда напыляется окислитель и восстановитель. Со временем, электрохимические реакции становятся слабыми, поскольку запасы окислительных и восстановительных материалов постепенно уменьшаются.
БАТАРЕИ ГАЛЬВАНИЧЕСКИЕ - группы электрически соединенных между собой гальванических элементов, которые вырабатывают электроэнергию за счет хим. реакции, происходящей между активными материалами электродов. В батареи гальванической чаще всего используются гальванические элементы, у которых положительный электрод изготовлен из смеси двуокиси марганца и графита, а отрицательный - из цинка. В качестве электролита обычно используется раствор хлористого аммония (нашатыря) и других хлористых солей. Такие элементы называются марганцево-цинковыми.
Рис. 1. Сухой элемент стаканчикового типа: 1 - отрицательный электрод (цинк), 2 - картонный футляр, 3 -токоотводы, 4 - колпачок, 5 - положительный электрод, 6 - слой электролита (пасты), 7 - смола, 8 - картонная шайба, 9 - изоляционная прокладка, 10 - стеклянная трубка (газоотвод)
Иногда в состав положительного электрода, кроме двуокиси марганца и графита, добавляется активированный уголь, который поглощает кислород из окружающей атмосферы, чем позволяет использовать его в хим. реакции. Такие элементы называются марганцево - воздушно - цинковыми. Они отличаются большей емкостью и меньшей себестоимостью. Для специальных целей применяются угольно - цинковые и железо - угольные наливные элементы, обладающие большим постоянством напряжения. Ввиду неудобства эксплуатации наливных элементов с жидким электролитом последний при помощи муки, крахмала, картона или других наполнителей переводится в вязкое состояние, благодаря чему он теряет свою текучесть и не выливается из элемента при любом положении. Такие элементы получили название сухих.
Различают два основных типа сухих элементов: стаканчиковый и галетный. У стаканчикового элемента (рис. 1) отрицательный электрод (цинковый полюс) выполнен в виде цилиндрического цельнотянутого или имеющего продольный шов (паяный, сварной, вальцованный) прямоугольного стакана. Положительный электрод представляет собой цилиндр или призму, напрессованную на угольный стержень, служащий токоотводом. Положительный электрод помещается внутри отрицательного, а пространство между ними заполняется сгущенным электролитом. У галетного элемента (рис.2) электроды имеют вид пластинок, которые разделены пропитанной электролитом картонной диафрагмой. Все детали стянуты упругим винилхлоридным ободом (кольцом). Токоотводом служит непроницаемый для электролита слой электропроводной массы, нанесенный на внешнюю сторону цинкового электрода. Марганцево - воздушно - цинковые элементы выпускаются только стаканчикового типа.

Рис. 2. Сухой элемент галетного типа: 1 - отрицательный электрод (цинк) с электропроводным слоем, 2 - положительный электрод, 3 - картонные диафрагмы, пропитанные электролитом, 4 - бумага обертки положительного электрода, 5 - хлорвиниловое кольцо
Основными показателями элемента являются его электродвижущая сила (э. д. с.) и напряжение, величина которых измеряется вольтметром (см.), в первом случае - при отсутствии нагрузочного сопротивления, во втором - при подключении обусловленного стандартом нагрузочного сопротивления. Э. д. с. марганцево - цинковых элементов колеблется от 1,5 до 1,8 В, э. д. с. марганцево - воздушно - цинковых элементов равна 1,4 В. Величина напряжения элемента всегда меньше э. д. с., разница между ними возрастает с уменьшением нагрузочного сопротивления. Важнейшими параметрами батарей гальванических являются также количество отдаваемой ими электроэнергии и способность сохранять ее на протяжении длительного времени (сохранность). Количество отдаваемой энергии измеряется либо продолжительностью работы элемента в часах, либо его электрической емкостью в а - час. Поскольку напряжение элемента при разряде падает, то в техн. документации всегда оговаривается нижний предел напряжения (конечное напряжение), определяющий нижнюю границу его работоспособности. При заданном конечном напряжении электрическая емкость элемента, а значит и продолжительность его работы зависят также от темп-ры и величины нагрузочного сопротивления (см. табл. 1), а также периодичности разряда.

Емкость батарей гальванических увеличивается с увеличением нагрузочного сопротивления и повышением темп-ры. Наиболее низкая темп-ра, при которой возможна работа элементов: для марганцево-цинковых -20°, для марганцево - воздушно - цинковых -5°. Периодичность разряда характеризуется чередованием и длительностью периодов разряда и отдыха элемента. Как правило, марганцево - цинковые элементы при прерывистом разряде отдают большую емкость, чем при непрерывном, а марганцево - воздушно - цинковые элементы, наоборот, меньшую.
Сохранностью батарей гальванических (элемента) называется срок от момента изготовления до начала эксплуатации, в продолжении которого изделие сохраняет свою работоспособность. Величина остающейся емкости (или продолжительности работы) оговаривается стандартом и обычно составляет 60-75% первоначальной.
Срок сохранности, указываемый на этикетке, является минимальным и почти всегда батареи гальванические и элементы могут быть использованы еще в течение некоторого времени. Годность их в этом случае определяется по напряжению.
Соединение элементов в батареи гальванические может быть последовательное, параллельное и смешанное. При последовательном соединении положительный полюс одного элемента присоединяется к отрицательному полюсу последующего элемента и т. д. (рис.3).

Рис. 3. Схема последовательного соединения элементов

Рис. 4. Схема параллельного соединения элементов батареи

Рис. 5. Смешанное соединение элементов батареи
Такое соединение элементов применяется для создания более высокого напряжения батареи гальванической, которое в этом случае прямо пропорционально числу последовательно соединенных элементов. Емкость батареи гальванической при этом не изменяется и равна емкости отдельного элемента. Параллельное соединение осуществляется путем соединения между собой, с одной стороны, всех положительных полюсов элементов, с другой - отрицательных (рис. 4). При этом возрастает емкость батареи гальванической, а напряжение ее остается равным напряжению отдельного элемента. При смешанном соединении применяются оба указанных выше способа: собирается несколько одинаковых групп с последовательным соединением элементов, которые соединяются между собой параллельно (рис. 5). При этом возрастают соответственно и напряжение и емкость.
В зависимости от назначения батареи гальванической подразделяются на анодные, сеточные, накальные и фонарные.
Анодные батареи гальванические (рис. 6) предназначаются для питания анодных цепей радиоприемников.

Рис. 6. Батарея БС-Г-70
Их напряжение сравнительно высоко - от 60 до 120 В. Используются они для небольшого тока - от 3 до 12 ма. Обычно эти батареи гальванические имеют дополнительные токоотводы в виде гнезда в панели или мягких проводов, которые позволяют использовать сначала часть батареи гальванической и подключать остальную ее часть по мере падения напряжения. Этот режим носит название секционного разряда и позволяет в известных пределах увеличить продолжительность службы батареи гальванической.
Сеточные батареи гальванические предназначаются для создания напряжения смещения на сетках радиоламп.

Рис. 7. Батарея БСГ-60-С-8
В них применяется последовательное соединение. Напряжение от 4,5 до 12,0 В. Расход тока не превышает 3 ма. Монтируются в одном футляре с батареями гальваническими анодными (рис. 7) и составляются из одинаковых с ними элементов.
Накальные батареи гальванические (рис. 8) предназначены для питания накальных нитей радиоламп.

Рис. 8. Батарея БНС-МВД-500
Для стационарных батарейных радиоприемников ("Родина", "Искра" и т. п.) накальные батареи гальванические с целью создания большей емкости составляются из четырех параллельно соединенных марганцево - воздушно - цинковых элементов большого размера. Напряжение их равно напряжению одного элемента, а расход тока от 0,3 до 0,5 а. В накальных батареях гальванических переносных батарейных радиоприемников применяется параллельное и смешанное соединение небольших элементов. Для батарейного радиоприемника "Тула" пром-стью выпускается комплект питания, в специальном футляре, состоящий из анодной и накальной батареи гальванической (рис. 9).

Рис. 9. Комплект - питания для радиоприемника "Тула"
Фонарные батареи гальванические предназначаются для питания лампочек карманных фонарей. Они характеризуются большим расходом тока (от 150 до 280 а) при небольшом напряжении (3,0- 4,5 в) и малыми габаритами. Наибольшее распространение получили батареи гальванические типа КБС-Л-0,50 (рис. 10), состоящие из трех последовательно соединенных элементов. Для фонарей круглого сечения и измерительных приборов (омметров, авометров и т. п.) пром-стью выпускаются элементы цилиндрической формы типа ФБС, последовательное соединение между которыми при необходимости осуществляется непосредственно при вложении их в корпус фонаря (прибора).

Рис. 10. Батарея для карманного фонаря КБС-Л-0,50
Условные обозначения элементов обычно состоят из четырех частей. Начальная цифра указывает габариты (в мм): №2 - 40х40х100, №3-55x55x130, № 6 - 80x80x175; буквы - С - сухой, Л - летний, X - хладостойкий; следующие затем цифры указывают емкость элемента. Так, 3С-Л-30 означает: элемент № 3, сухой, летний, емкостью 30 а-час. Наименование батарей гальванических, начинающееся с буквенных обозначений, состоит из 4-5 частей, имеющих следующие значения: Б - батарея, А - анодная, Н - накальная, С - сухая, Г - галетная, Ф - фонарная, К - карманная. Число после букв у анодных батарей гальванических показывает напряжение, у накальных - емкость. Однако иногда в обозначении батарей гальванических анодных буква А опускается, а в конце обозначения добавляется второй численный показатель - емкость батареи гальванической. Наименования батарей гальванических, начинающиеся с цифр, имеют следующие значения: начальная цифра обозначает напряжение, конечная - емкость, буквы: МЦ - марганцевоцинковая система, В - указывает на использование кислорода воздуха, Н - накальная, А - анодная, Т - телефонная, С - для слуховых аппаратов, П - панель. Батареям гальваническим, предназначенным для питания радиоприемников, кроме того, даны товарные наименования. Маркируются батареи гальванические путем наклейки этикетки с указанием: наименования или товарного знака предприятия - изготовителя, условного обозначения батарей гальванических, номинального напряжения, начальной емкости, гарантийного срока хранения и емкости в конце срока хранения.
Годность батарей гальванических и элементов определяется внешним осмотром и замерением напряжения на токоотводах. При осмотре следует убедиться в целости токоотводов и отсутствии наружных дефектов: поломок, разрушения заливочной смолки (мастики), повреждений и промокания футляра. Напряжение проверяется вольтметром; оно не должно быть ниже величин, указанных в табл. 2. Батареи гальванические упаковываются в деревянные ящики весом брутто 65-80 кг, выложенные внутри влагонепроницаемой бумагой, и отделяются от их стенок слоем сухой стружки или другого упаковочного материала. Батареи гальванические необходимо хранить в сухом и прохладном месте. Повышенная влажность в помещении для хранения, как и повышенная темп-ра, резко снижают срок их сохранности. Низкая темп-ра не опасна для батарей гальванических: после отогревания они полностью восстанавливают свои свойства. Батареи гальванические изготовляются предприятиями Главаккумуляторпрома Министерства электротехнической промышленности СССР.
Лит.: Сочеванов В.Г., Гальванические элементы, М., 1951; Морозов ГГ. и Гантмав С.А., Химические источники тока для питания средств связи, М., 1949; Сводный каталог на химические источники тока, М., 1950.
Маломощные источники электрической энергии
Для питания переносной электро- и радиоаппаратуры применяют гальванические элементы и аккумуляторы.
Гальванические элементы - это источники одноразового действия, аккумуляторы - источники многоразового действия.
Простейший гальванические элемент
Простейший элемент может быть изготовлен из двух полосок: медной и цинковой, погруженных в воду, слегка подкисленную серной кислотой. Если цинк достаточно чист, чтобы быть свободным от местных реакций, никаких заметных изменений не произойдет до тех пор, пока медь и цинк не будут соединены проводом.
Однако полоски имеют разные потенциалы одна по отношению к другой, и когда они будут соединены проводом, в нем появится . По мере этого действия цинковая полоска будет постепенно растворяться, а близ медного электрода будут образовываться пузырьки газа, собирающиеся на его поверхности. Этот газ - водород, образующийся из электролита. Электрический ток идет от медной полоски по проводу к цинковой полоске, а от нее через электролит обратно к меди.

Постепенно серная кислота электролита замещается сульфатом цинка, образующимся из растворенной части цинкового электрода. Благодаря этому напряжение элемента уменьшается. Однако еще более сильное падение напряжения вызывается образованием газовых пузырьков на меди. Оба эти действия производят «поляризацию». Подобные элементы не имеют почти никакого практического значения.
Важные параметры гальванических элементов
Величина напряжения, даваемого гальваническими элементами, зависит только от их типа и устройства, т. е. от материала электродов и химического состава электролита, но не зависит от формы и размеров элементов.
Сила тока, которую может давать гальванический элемент, ограничивается его внутренним сопротивлением.
Очень важной характеристикой гальванического элемента является . Под электрической емкостью подразумевается то количество электричества, которое гальванический или аккумуляторный элемент способен отдать в течение всего времени своей работы, т. е. до наступления окончательного разряда.
Отданная элементом емкость определяется умножением силы разрядного тока, выраженной в амперах, на время в часах, в течение которого разряжался элемент вплоть до наступления полного разряда. Поэтому электрическая емкость выражается всегда в ампер-часах (А х ч).

По величине емкости элемента можно также заранее определить, сколько примерно часов он будет работать до наступления полного разряда. Для этого нужно емкость разделить на допустимую для этого элемента силу разрядного тока.
Однако электрическая емкость не является величиной строго постоянной. Она изменяется в довольно больших пределах в зависимости от условий (режима) работы элемента и конечною разрядного напряжения.
Если элемент разряжать предельной силой тока и притом без перерывов, то он отдаст значительно меньшую емкость. Наоборот, при разряде того же элемента током меньшей силы и с частыми и сравнительно продолжительными перерывами элемент отдаст полную емкость.
Что же касается влияния на емкость элемента конечного разрядного напряжения, то нужно иметь в виду, что в процессе разряда гальванического элемента его рабочее напряжение не остается на одном уровне, а постепенно понижается.

Распространенные виды гальванических элементов
Наиболее распространены гальванические элементы марганцево-цинковой, марганцево-воздушной, воздушно-цинковой и ртутно-цинковой систем с солевым и щелочным электролитами. Сухие марганцево-цинковые элементы с солевым электролитом имеют начальное напряжение от 1,4 до 1,55 В, продолжительность работы при температуре окружающей среды от -20 до -60 о С от 7 ч до 340 ч.
Сухие марганцево-цинковые и воздушно-цинковые элементы со щелочным электролитом имеют напряжение от 0,75 до 0,9 В и продолжительность работы от 6 ч до 45 ч.
Сухие ртутно-цинковые элементы имеют начальное напряжение от 1,22 до 1,25 В и продолжительность работы от 24 ч до 55 ч.
Наибольший гарантийный срок хранения, достигающий 30 месяцев, имеют сухие ртутно-цинковые элементы.

Это вторичные гальванические элементы. В отличие от гальванических элементов в аккумуляторе же сразу после сборки никакие химические процессы не возникают.
Чтобы в аккумуляторе начались химические реакции, связанные с движением электрических зарядов, нужно соответствующим образом изменить химический состав его электродов (а частью и электролита). Это изменение химического состава электродов происходит под действием пропускаемого через аккумулятор электрического тока.
Поэтому, чтобы аккумулятор мог давать электрический ток, его предварительно нужно «зарядить» постоянным электрическим током от какого-нибудь постороннего источника тока.
От обычных гальванических элементов аккумуляторы выгодно отличаются также тем, что после разряда они опять могут быть заряжены. При хорошем уходе за ними и при нормальных условиях эксплуатации аккумуляторы выдерживают до нескольких тысяч зарядов и разрядок.
 Устройство аккумулятора
Устройство аккумулятора
В настоящее время наиболее часто на практике применяют свинцовые и кадмиево-никелевые аккумуляторы. У первых электролитом служит раствор серной кислоты, а у вторых - раствор щелочей в воде. Свинцовые аккумуляторы называют также кислотными, а кадмиево-никелевые - щелочными.
Принцип работы аккумуляторов основан на поляризации электродов . Простейший кислотный аккумулятор устроен следующим образом: это две свинцовые пластины, опущенные в электролит. В результате химической реакции замещения пластины покрываются слабым налетом сернокислого свинца PbSO4, как это следует из формулы Pb + H 2 SO 4 = PbSO 4 + Н 2 .

Устройство кислотного аккумулятора
Такое состояние пластин соответствует разряженному аккумулятору. Если теперь аккумулятор включить на заряд, т. е. подсоединить его к генератору постоянного тока, то в нем вследствие электролиза начнется поляризация пластин. В результате заряда аккумулятора его пластины поляризуются, т. е. изменяют вещество своей поверхности, и из однородных (PbSO 4) превращаются в разнородные (Pb и Рb О 2 ).
Аккумулятор становится источником тока, причем положительным электродом у него служит пластина, покрытая двуокисью свинца, а отрицательным - чистая свинцовая пластина.
К концу заряда концентрация электролита повышается вследствие появления в нем дополнительных молекул серной кислоты.
В этом одна из особенностей свинцового аккумулятора: его электролит не остается нейтральным и сам участвует в химических реакциях при работе аккумулятора.
К концу разряда обе пластины аккумулятора опять покрываются сернокислым свинцом, в результате чего аккумулятор перестает быть источником тока. До такого состояния аккумулятор никогда не доводят. Вследствие образования сернокислого свинца на пластинах, концентрация электролита в конце разряда понижается. Если аккумулятор поставить на заряд, то вновь можно вызвать поляризацию, чтобы опять поставить его на разряд и т. д.

Существует несколько способов заряда аккумуляторов. Наиболее простой - нормальный заряд аккумулятора, который происходит следующим образом. Вначале на протяжении 5 - 6 ч заряд ведут двойным нормальным током, пока напряжение на каждой аккумуляторной банке не достигнет 2,4 В.
Нормальный зарядный ток определяют по формуле I зар = Q/16
Где Q - номинальная емкость аккумулятора, Ач.
После этого зарядный ток уменьшают до нормального значения и продолжают заряд и течение 15 - 18 ч, до появления признаков конца заряда.

Современные аккумуляторы
Кадмиево-никелевые, или щелочные аккумуляторы, появились значительно позже свинцовых и по сравнению с ними представляют собой более совершенные химические источники тока. Главное преимущество щелочных аккумуляторов перед свинцовыми заключается в химической нейтральности их электролита по отношению к активным массам пластин. Благодаря этому саморазряд у щелочных аккумуляторов получается значительно меньше, чем у свинцовых. Принцип действия щелочных аккумуляторов также основан на поляризации электродов при электролизе.
Для питания радиоаппаратуры выпускают герметичные кадмиево-никелевые аккумуляторы, которые работоспособны при температурах от -30 до +50 о С и выдерживают 400 - 600 циклов заряд-разряд. Эти аккумуляторы выполняют в форме компактных параллелепипедов и дисков с массой от нескольких граммов до килограммов.
Выпускают никель-водородные аккумуляторы для энергоснабжения автономных объектов. Удельная энергия никель-водородного аккумулятора составляет 50 - 60 Вт ч кг -1 .
В первых опытах ученых в емкость с кислотой опускали две металлические пластины: медную и цинковую. Пластины соединяли проводником, после чего на медной пластине появлялись газовые пузырьки, а цинковая пластина стала растворяться. Было доказано, что по проводнику проходит электрический ток. Это исследование начинал итальянский ученый Гальвани, от него и получили название гальванические элементы.
После этого ученый Вольта разработал цилиндрическую форму этого элемента в виде вертикального столбика, включающего в себя набор колец меди, цинка и сукна, соединенных друг с другом, и пропитанных кислотой. Разработанный Вольтом вертикальный элемент полуметровой высоты вырабатывал напряжение, которое мог почувствовать человек.
Гальванические элементы — это источники электрической энергии, вырабатывающие электрический ток методом химического взаимодействия двух металлов в электролите. Химическая энергия в гальванических элементах преобразуется в электрический ток.
Принцип работы
Действие гальванических элементов основано на том, что два разных металла в среде электролита взаимодействуют между собой, в результате чего во внешней цепи образуется электрический ток.
Такие химические элементы сегодня называют батарейками. Величина напряжения батарейки зависит от применяемых видов металлов и от числа элементов, находящихся в ней. Все устройство батарейки расположено в металлическом цилиндре. Электроды представляют собой металлические сетки с напылением восстановителя и окислителя.
Батарейки не могут восстанавливать утраченные свойства, так как в них осуществляется прямое преобразование химической энергии окислителя и восстановителя в электрическую. Химические реагенты при функционировании батарейки постепенно расходуются, а электрический ток уменьшается.
Отрицательный вывод батарейки выполнен из цинка или лития, он теряет электроны и является восстановителем. Другой положительный вывод играет роль окислителя, его изготавливают из оксида магния или солей металлов. Состав электролита в обычных условиях не пропускает через себя электрический ток. При замыкании электрической цепи начинается распад электролита на ионы, что обуславливает появление его электрической проводимости. Электролит состоит чаще всего из раствора кислоты или солей натрия и калия.
Виды и особенности устройства
Батарейки широко используются для питания разных электронных устройств, приборов, цифровой техники и делятся на три вида:
- Щелочные.
- Солевые.
- Литиевые.
Солевые гальванические элементы
Такие батарейки относятся к марганцево-цинковым элементам питания, и являются наиболее применяемыми в настоящее время.
Достоинствами солевых батареек являются:
- Приемлемые электрические параметры для многих областей использования.
- Удобство применения.
- Малая цена ввиду небольших расходов на изготовление.
- Простая технология изготовления.
- Дешевое и доступное сырье.
Длительное время этот вид батареек является наиболее популярным, благодаря соотношению качества и цены. Однако в последние годы заводы изготовители уменьшают производство солевых гальванических элементов, и даже отказываются от выпуска, так как требования к источникам питания повышаются производителями электронной техники.
Недостатками солевых батареек являются:
- Малый срок хранения, не более 2-х лет.
- Резкое падение свойств при снижении температуры.
- Резкое уменьшение емкости при повышении рабочего тока до эксплуатационных значений современных потребителей.
- Быстрое уменьшение напряжения во время работы.
Солевые гальванические элементы в конце своего разряда могут потечь, что связано с вытеканием электролита из-за увеличения объема положительного электрода, который выдавливает электролит. Активная масса плюсового электрода состоит из диоксида марганца и электролита. Сажа и графит, добавленный в активную смесь, повышают электропроводность активной смеси. Их доля равна от 8 до 20% в зависимости от марки батарейки. Для увеличения срока работы окислителя активную смесь насыщают электролитом.
Минусовой электрод изготавливают из очищенного цинка, устойчивого к коррозии. В нем остается небольшая доля кадмия или свинца, являющегося ингибиторами коррозии. Раньше в батарейках в качестве электролита использовали хлорид аммония. Он участвует в реакции образования тока, создает проходимость ионов. Но такой электролит не показал хороших результатов, и его заменили хлоридом цинка с примесями хлорида кальция. Марганцево-кислые элементы работают дольше, и показывают лучшие результаты при пониженных температурах.

В солевых гальванических элементах отрицательным полюсом является цинковый корпус 7. Плюсовой электрод 6 изготовлен из активной прессованной массы, пропитанной электролитом. По центру этой массы находится угольный стержень 5, обработанный парафином для удержания влаги в электролите. Верхняя часть стержня закрыта металлическим колпаком. В сепараторе 4 находится густой электролит. В газовую камеру 1 поступают газы, образованные при работе батарейки. Сверху батарейку закрывают прокладкой 3. Весь гальванический элемент заключают в футляр 2, выполненный из картона или фольги.
Щелочные батарейки
Щелочные элементы питания появились в середине прошлого века. В них в качестве окислителя выступает диоксид марганца, а в качестве восстановителя порошковый цинк. Это дает возможность увеличить поверхность. Для предохранения от коррозии раньше применялось амальгамирование. Но после запрета на ртуть используют очищенные цинковые порошки с добавлением других металлов и ингибиторов коррозии.
Активным веществом анода щелочной (алкалиновой ) батарейки стал очищенный цинк в виде порошка с добавлением алюминия, индия или свинца. Активная смесь катода включает в себя диоксид марганца, ацетиленовую сажу или графит. Электролит алкалиновых батареек состоит из едкого натра или калия с добавлением оксида цинка.
Порошковый анод позволяет значительно повысить использование активной смеси, в отличие от солевых батареек. Алкалиновые батарейки обладают значительно большей емкостью, чем солевые, при равных габаритных размерах. Они хорошо себя показали в работе на морозе.
Особенностью устройства алкалиновых элементов является порошковый цинк, поэтому вместо цинкового стакана используют стальной корпус для положительного вывода. Активная смесь положительного электрода находится возле внутренней стенки стального корпуса. В алкалиновой батарейке есть возможность разместить больше активной смеси положительного электрода, в отличие от солевой.

В активную смесь вставляется целлофановый сепаратор, смоченный электролитом. По центру батарейки проходит латунный отрицательный электрод. Остальной объем между сепаратором и отрицательным токоотводом заполняется анодной пастой в виде порошкового цинка, пропитанного густым электролитом. Обычно в качестве электролита используют щелочь, насыщенную специальными соединениями цинка. Это дает возможность предотвратить потребление щелочи в начале работы элемента, и снизить коррозию. Масса щелочных батареек выше солевых из-за стального корпуса и большей плотности активной смеси.
По многим основным параметрам алкалиновые гальванические элементы превосходят солевые элементы. Поэтому в настоящее время увеличивается объем производства щелочных батареек.
Литиевые элементы питания
Литиевые гальванические элементы применяются в различных современных устройствах. Они выпускаются различных типоразмеров и видов.

Существуют литиевые батарейки и , имеющие между собой большие отличия. Батарейки имеют в составе твердый органический электролит, в отличие от других видов элементов. Литиевые элементы используются в местах, где требуются средние и малые токи разряда, стабильное рабочее напряжение. Литиевый аккумулятор можно перезаряжать определенное количество раз, а батарейки не предназначены для этого, и используются только один раз. Их запрещается вскрывать или перезаряжать.
Основные требования к производству
- Надежная герметизация корпуса. Нельзя допускать утечки электролита и проникновения внутрь других веществ из внешней среды. Нарушение герметичности приводит к их возгоранию, так как литий является высоко активным элементом. Гальванические элементы с нарушенной герметичностью не годятся для эксплуатации.
- Изготовление должно проходить в герметичных помещениях с аргоновой атмосферой и контролем влажности.
Форма литиевых аккумуляторов бывает цилиндрической, дисковой или призматической. Габариты практически не отличаются от других видов батареек.
Область использования
Литиевые гальванические элементы обладают более длительным сроком работы, по сравнению с другими элементами. Область применения очень широка:
- Космическая промышленность.
- Авиационное производство.
- Оборонная промышленность.
- Детские игрушки.
- Медицинская техника.
- Компьютеры.
- Фото- и видеокамеры.
Преимущества
- Широкий интервал рабочих температур.
- Компактные размеры и масса.
- Длительная эксплуатация.
- Стабильные параметры в различных условиях.
- Большая емкость.
Предпосылки к появлению гальванических элементов. Немного истории. В 1786 году итальянский профессор медицины, физиолог Луиджи Алоизио Гальвани обнаружил интересное явление: мышцы задних лапок свежевскрытого трупика лягушки, подвешенного на медных крючках, сокращались, когда ученый прикасался к ним стальным скальпелем. Гальвани тут же сделал вывод, что это — проявление «животного электричества».
После смерти Гальвани, его современник Алессандро Вольта, будучи химиком и физиком, опишет и публично продемонстрирует более реальный механизм возникновения электрического тока при контакте разных металлов.
Вольта, после серии экспериментов, придет к однозначному выводу о том, что ток появляется в цепи из-за наличия в ней двух проводников из разных металлов, помещенных в жидкость, и это вовсе не «животное электричество», как думал Гальвани. Подергивание лапок лягушки было следствием действия тока, возникающего при контакте разных металлов (медные крючки и стальной скальпель).
Вольта покажет те же явления, которые демонстрировал Гальвани на мертвой лягушке, но на совершенно неживом самодельном электрометре, и даст в 1800 году точное объяснение возникновению тока: «проводник второго класса (жидкий) находится в середине и соприкасается с двумя проводниками первого класса из двух различных металлов… Вследствие этого возникает электрический ток того или иного направления».

В одном из первых экспериментов Вольта опустил в банку с кислотой две пластинки — цинковую и медную — и соединил их проволокой. После этого цинковая пластина начала растворяться, а на медной стали выделяться пузырьки газа. Вольта предположил и доказал, что по проволоке протекает электрический ток.
Так был изобретён «элемент Вольта» — первый гальванический элемент. Для удобства Вольта придал ему форму вертикального цилиндра (столба), состоящего из соединённых между собой колец цинка, меди и сукна, пропитанных кислотой. Вольтов столб высотою в полметра создавал напряжение, чувствительное для человека.
Поскольку начало исследованиям положил Луиджи Гальвани, то и название сохранило память о нем в своем названии.
Гальванический элемент — это химический источник электрического тока, основанный на взаимодействии двух металлов и/или их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Таким образом, в гальванических элементах химическая энергия переходит в электрическую.
Гальванические элементы сегодня

Гальванические элементы сегодня называют батарейками. Широко распространены три типа батареек: солевые (сухие), щелочные (их называют еще алкалиновыми, «alkaline» в переводе с английского - «щелочной») и литиевые. Принцип их работы — все тот же, описанный Вольта в 1800 году: два металла , и во внешней замкнутой цепи возникает электрический ток.

Напряжение батарейки зависит как от используемых металлов, так и от количества элементов в «батарейке». Батарейки, в отличие от аккумуляторов, не способны к восстановлению своих свойств, поскольку в них происходит прямое преобразование энергии химической, то есть энергии составляющих батарейку реагентов (восстановителя и окислителя), в энергию электрическую.
Входящие в батарейку реагенты, в процессе ее работы расходуются, ток при этом постепенно уменьшается, поэтому действие источника заканчивается после того как реагенты прореагируют полностью.
Щелочные и солевые элементы (батарейки) широко применяются для питания разнообразных электронных устройств, радиоаппаратуры, игрушек, а литиевые чаще всего можно встретить в портативных медицинских приборах типа глюкометров или в цифровой технике вроде фотоаппаратов.

Марганцево-цинковые элементы, которые называют солевыми батарейками — это «сухие» гальванические элементы, внутри которых нет жидкого раствора электролита.
Цинковый электрод (+) — это катод в форме стакана, а анодом служит порошкообразная смесь из диоксида марганца с графитом. Ток течет через графитовый стержень. В качестве электролита используется паста из раствора хлорида аммония с добавлением крахмала или муки для загущения, чтобы ничего не текло.
Обычно производители батареек не указывают точный состав солевых элементов, тем не менее, солевые батарейки являются самыми дешевыми, их обычно используют в тех устройствах, где энергопотребление крайне низко: в часах, в пультах дистанционного управления, в электронных термометрах и т. п.

Понятие "номинальная емкость" редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации. Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.

Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться в следствии саморазряда.
Выше на графике изображены разрядные кривые для средней солевой батарейки за 4, 10, 20 и 40 часов для сравнения с щелочной, о которой речь пойдет далее.
Щелочной элемент питания — марганцево-цинковый гальванический элемент питания, в котором в качестве катода используется диоксид марганца, в качестве анода — порошкообразный цинк, а в качестве электролита — раствор щёлочи, обычно в виде пасты гидроксида калия.
Эти батарейки обладают целым рядом преимуществ (в частности, существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки).

Щелочные батарейки, в сравнении с солевыми, могут обеспечивать больший ток в течение длительного времени. Больший ток становится возможным, поскольку цинк здесь используется не в виде стакана, а в виде порошка, обладающего большей площадью соприкосновения с электролитом. В качестве электролита применяется гидрооксид калия в виде пасты.

Именно благодаря способности данного вида гальванических элементов в течение длительного времени отдавать значительный ток (до 1 A), щелочные батарейки наиболее распространены в настоящее время.
В электрических игрушках, в портативной медицинской технике, в электронных приборах, в фотоаппаратах — всюду применяются щелочные батарейки. Они служат в 1,5 раза дольше солевых, если разряд идет малым током. На графике изображены разрядные кривые при различных токах для сравнения с солевой батарейкой (график был приведен выше) за 4, 10, 20 и 40 часов.
Литиевые батарейки
Еще одним достаточно распространенным видом гальванических элементов являются литиевые батарейки - одиночные неперезаряжаемые гальванические элементы, в которых в качестве анода используется литий или его соединения. Благодаря использованию щелочного металла они обладают высокой разностью потенциалов.

Катод и электролит литиевого элемента могут быть очень разными, поэтому термин «литиевый элемент» объединяет группу элементов с одинаковым материалом анода. В качестве катода могут использоваться например: диоксид марганца, монофторид углерода, пирит, тионилхлорид и др.
Литиевые батарейки отличается от других элементов питания высокой продолжительностью работы и высокой стоимостью. В зависимости от выбранного типоразмера и используемых химических материалов, литиевый элемент питания может производить напряжение от 1,5 В (совместим с щелочными батареями) до 3,7 В.
Эти элементы питания обладают наивысшей емкостью на единицу массы и длительным временем хранения. Литиевые элементы широко применяются в современной портативной электронной технике: для питания часов на материнских платах компьютеров, для питания портативных медицинских приборов, наручных часов, калькуляторов, в фототехнике и т. д.
На графике выше приведены разрядные кривые для двух литиевых батареек от двух популярных производителей. Начальный ток составлял 120 мА (на резистор порядка 24 Ома).