Тип связи и вид кристаллической решетки алюминия. Кристаллическое строение металлов
Читайте также
Строение вещества.
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со строением вещества.
При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы.
Жидкие кристаллы открыты в конце XIX века, но изучены в последние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд плавится при температуре выше 2000 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т.е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решёток.
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК



Свойства веществ с различной кристаллической решёткой (таблица)
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.

Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:
- Что такое кристаллическая решётка?
- Какие виды кристаллических решёток существуют?
- Охарактеризуйте каждый вид кристаллической решётки по плану:
Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (CH3
COOH), сахар (C12
H22
O11
), калийное удобрение (KCl), речной песок (SiO2
) – температура плавления 1710 0C, аммиак (NH3
), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
По формулам приведённых веществ: SiC, CS2
, NaBr, C2
H2
- определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
Тренажёр №1. "Кристаллические решётки"
Тренажёр №2. "Тестовые задания"
Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a). тугоплавки и хорошо растворимы в воде
б). легкоплавки и летучи
в). Тверды и электропроводны
г). Теплопроводны и пластичны
2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
б). кислород
в). алмаз
3) Атомная кристаллическая решётка характерна для:
a). алюминия и графита
б). серы и йода
в). оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
А). молекулярная
б). атомная
в). ионная
г). металлическая
В природе есть два вида твердых тел, которые заметно различаются своими свойствами. Это аморфные и кристаллические тела. И аморфные тела не имеют точной температуры плавления, они во время нагревания постепенно размягчаются, а затем переходят в текучее состояния. Примером таких веществ может служить смола или обычный пластилин. Но совсем по-другому дело обстоит с кристаллическими веществами. Они остаются в твердом состоянии до какой-то определенной температуры, и только достигнув ее, эти вещества расплавляются.
Здесь все дело в строении таких веществ. В кристаллических телах частицы, из которых они состоят, расположены в определенных точках. И если их соединить прямыми линиями, то получится некий воображаемый каркас, который так и называется - кристаллическая решетка. А типы кристаллических решеток могут быть самые разные. И по виду частиц, из которых они «построены», решетки делятся на четыре типа. Это ионная, атомная, молекулярная и
И в узлах соответственно, расположены ионы, и между ними существует ионная связь. могут быть как простыми (Cl-, Na+), так и сложными (OH-, SO2-). И такие типы кристаллических решеток могут содержать некоторые гидроксиды и оксиды металлов, соли и другие подобные вещества. Возьмем, к примеру, обычный хлорид натрия. В нем чередуются отрицательные ионы хлора и положительные ионы натрия, которые образуют кубическую кристаллическую решетку. Ионные связи в такой решетке весьма устойчивы и вещества, «построенные» по такому принципу, имеют достаточно высокую прочность и твердость.
Есть также типы кристаллических решеток, называемых атомными. Здесь в узлах расположены атомы, между которыми существует сильная ковалентная связь. Атомную решетку имеют не очень много веществ. К ним относится алмаз, а также кристаллический германий, кремний и бор. Есть еще некоторые сложные вещества, которые содержат и имеют, соответственно, атомную кристаллическую решетку. Это горный хрусталь и кремнезем. И в большинстве случаев такие вещества очень прочные, твердые и тугоплавкие. Также они практически нерастворимы.
А молекулярные типы кристаллических решеток имеют самые разные вещества. К ним относится замерзшая вода, то есть обычный лед, «сухой лед» - затвердевший оксид углерода, а также твердый сероводород и хлороводород. Еще молекулярные решетки имеют много твердых органических соединений. К ним относится сахар, глюкоза, нафталин и прочие подобные вещества. А молекулы, находящиеся в узлах такой решетки, связаны между собой полярными и неполярными химическими связями. И несмотря на то, что внутри молекул между атомами существуют прочные ковалентные связи, сами эти молекулы держатся в решетке за счет очень слабых межмолекулярных связей. Поэтому такие вещества достаточно летучи, легко плавятся и не обладают большой твердостью.
Ну а металлы имеют самые разные виды кристаллических решеток. И в их узлах могут находиться как атомы, так и ионы. При этом атомы могут легко превращаться в ионы, отдавая свои электроны в «общее пользование». Таким же образом ионы, «захватив» свободный электрон, могут становиться атомами. И такое решетки определяет такие свойства металлов, как пластичность, ковкость, тепло- и электропроводимость.
Также типы кристаллических решеток металлов, да и других веществ, делятся на семь основных систем по форме элементарных ячеек решетки. Самой простой является кубическая ячейка. Есть также ромбические, тетрагональные, гексагональные, ромбоэдрические, моноклинные и триклинные элементарные ячейки, которые определяют форму всей кристаллической решетки. Но в большинстве случаев кристаллические решетки являются более сложными, чем те, что перечислены выше. Это связано с тем, что элементарные частицы могут находиться не только в самих узлах решетки, а и в ее центре или на ее гранях. И среди металлов наиболее распространены такие три сложные кристаллические решетки: гранецентрированная кубическая, объемно-центрированная кубическая и гексагональная плотноупакованная. Еще физические характеристики металлов зависят не только от формы их кристаллической решетки, а и от межатомного расстояния и от других параметров.
Строение вещества определяется не только взаимным расположением атомов в химических частицах, но и расположением этих химических частиц в пространстве. Наиболее упорядочено размещение атомов, молекул и ионов в кристаллах (от греческого "кристаллос " - лед), где химические частицы (атомы, молекулы, ионы) расположены в определенном порядке, образуя в пространстве кристаллическую решетку. При определенных условиях образования они могут иметь естественную форму правильных симметричных многогранников. Кристаллическое состояние характеризуется наличием дальнего порядка в расположении частиц и симметрией кристаллической решетки.
Для аморфного состояния характерно наличие только ближнего порядка. Структуры аморфных веществ напоминают жидкости, однако обладают гораздо меньшей текучестью. Аморфное состояние обычно неустойчиво. Под действием механических нагрузок или при изменении температуры аморфные тела могут закристаллизоваться. Реакционная способность веществ в аморфном состоянии значительно выше, чем в кристаллическом.
Аморфные вещества
Главный признак аморфного (от греческого "аморфос " - бесформенный) состояние вещества - отсутствие атомной или молекулярной решетки, то есть трехмерной периодичности структуры, характерной для кристаллического состояния.
При охлаждении жидкого вещества не всегда происходит его кристаллизация. при определенных условиях может образоваться неравновесное твердое аморфное (стеклообразное) состояние. В стеклообразном состоянии могут находиться простые вещества (углерод, фосфор мышьяк, сера, селен), оксиды (например, бора, кремния, фосфора), галогениды, халькогениды, многие органические полимеры.
В этом состоянии вещество может быть устойчиво в течение длительного промежутка времени, например, возраст некоторых вулканических стекол исчисляется миллионами лет. Физические и химические свойства вещества в стеклообразном аморфном состоянии могут существенно отличаться от свойств кристаллического вещества. Например, стеклообразный диоксид германия химически более активен, чем кристаллический. Различия в свойствах жидкого и твердого аморфного состояния определятся характером теплового движения частиц: в аморфном состоянии частицы способны лишь к колебательным и вращательным движениям, но не могут перемещаться в толще вещества.
Существуют вещества, которые в твердом виде могут находиться только в аморфном состоянии. Это относится к полимерам с нерегулярной последовательностью звеньев.
Аморфные тела изотропны , то есть их механические, оптические, электрические и другие свойства не зависят от направления. У аморфных тел нет фиксированной температуры плавления: плавление происходит в некотором температурном интервале. Переход аморфного вещества из твердого состояния в жидкое не сопровождается скачкообразным изменением свойств. Физическая модель аморфного состояния до сих пор не создана.
Кристаллические вещества
Твердые кристаллы - трехмерные образования, характеризующиеся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки ) во всех направлениях. Элементарная ячейка представляет собой наименьший объем кристалла в виде параллелепипеда, повторяющегося в кристалле бесконечное число раз.
Геометрически правильная форма кристаллов обусловлена, прежде всего, их строго закономерным внутренним строением. Если вместо атомов, ионов или молекул в кристалле изобразить точки как центры тяжести этих частиц, то получится трехмерное регулярное распределение таких точек, называемое кристаллической решеткой. Сами точки называют узлами кристаллической решетки.
Типы кристаллических решеток
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллов.
Ионные кристаллы образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.

Ионные кристаллы могут состоять из одноатомных
ионов. Так построены кристаллы хлорида натрия
, иодида калия, фторида кальция.
В образовании ионных кристаллов многих солей участвуют одноатомные катионы металлов и многоатомные анионы, например, нитрат-ион NO 3 − , сульфат-ион SO 4 2− , карбонат-ион CO 3 2− .
В ионном кристалле невозможно выделить одиночные молекулы. Каждый катион притягивается к каждому аниону и отталкивается от других катионов. Весь кристалл можно считать огромной молекулой. Размеры такой молекулы не ограничены, поскольку она может расти, присоединяя новые катионы и анионы.
Большинство ионных соединений кристаллизуется по одному из структурных типов, которые отличаются друг от друга значением координационного числа, то есть числом соседей вокруг данного иона (4, 6 или 8). Для ионных соединений с равным числом катионов и анионов известно четыре основных типа кристаллических решеток: хлорида натрия (координационное число обоих ионов равно 6), хлорида цезия (координационное число обоих ионов равно 8), сфалерита и вюрцита (оба структурных типа характеризуются координационном числом катиона и аниона, равным 4). Если число катионов вдвое меньше числа анионов, то координационное число катионов должно быть вдвое больше координационного числа анионов. В этом случае реализуются структурные типы флюорита (координационные числа 8 и 4), рутила (координационные числа 6 и 3), кристобалита (координационные числа 4 и 2).
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Высокая растворимость в полярных растворителях, сопровождающаяся электролитической диссоциацией обусловлена тем, что в среде растворителя с высокой диэлектрической проницаемостью ε уменьшается энергия притяжения между ионами. Диэлектрическая проницаемость воды в 82 раза выше, чем вакуума (условно существующего в ионном кристалле), во столько же раз уменьшается притяжение между ионами в водном растворе. Эффект усиливается за счет сольватации ионов.
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния) также образуют атомные кристаллы.
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Межмолекулярные силы возникают за счет электростатического взаимодействия отрицательно заряженных электронов одной молекулы с положительно заряженными ядрами соседних молекул. На силу межмолекулярного взаимодействия влияет много факторов. Важнейшими среди них является наличие полярных связей, то есть смещения электронной плотности от одних атомов к другим. Кроме того, межмолекулярное взаимодействие проявляется сильнее между молекулами с большим числом электронов.

Большинство неметаллов в виде простых веществ (например, иод I 2 , аргон Ar, сера S 8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Для металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.

Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.
Изоморфизм и полиморфизм
Многие кристаллические вещества имеют одинаковые структуры. В то же время одно и то же вещество может образовывать разные кристаллические структуры. Это находит отражение в явлениях изоморфизма и полиморфизма .
Изоморфизм заключается в способности атомов, ионов или молекул замещать друг друга в кристаллических структурах. Этот термин (от греческих "изос " - равный и "морфе " - форма) был предложен Э. Мичерлихом в 1819 г. Закон изоморфизма бы сформулирован Э. Мичерлихом в 1821 г. таким образом: "Одинаковые количества атомов, соединенные одинаковым способом, дают одинаковые кристаллические формы; при этом кристаллическая форма не зависит от химической природы атомов, а определяется только их числом и относительным положением".
Работая в химической лаборатории Берлинского университета, Мичерлих обратил внимание на полное сходство кристаллов сульфатов свинца, бария и стронция и близость кристаллических форм многих других веществ. Его наблюдения привлекли внимание известного шведского химика Й.-Я. Берцелиуса , который предложил Мичерлиху подтвердить замеченные закономерности на примере соединений фосфорной и мышьяковой кислот. В результате проведенного исследования был сделан вывод, что "две серии солей различаются лишь тем, что в одной в качестве радикала кислоты присутствует мышьяк, а в другой - фосфор". Открытие Мичерлиха очень скоро привлекло внимание минералогов, начавших исследования по проблеме изоморфного замещения элементов в минералах.
При совместной кристаллизации веществ, склонных к изоморфизму (изоморфных веществ), образуются смешанные кристаллы (изоморфные смеси). Это возможно лишь в том случае, если замещающие друг друга частицы мало различаются по размерам (не более 15%). Кроме того, изоморфные вещества должны иметь сходное пространственное расположение атомов или ионов и, значит, сходные по внешней форме кристаллы. К таким веществам относятся, например, квасцы. В кристаллах алюмокалиевых квасцов KAl(SO 4) 2 . 12H 2 O катионы калия могут быть частично или полностью заменены катионами рубидия или аммония, а катионы алюминия - катионами хрома(III) или железа(III).
Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава. Например, в минерале сфалерите ZnS до 20% атомов цинка могут быть замещены атомами железа (при этом ZnS и FeS имеют разные кристаллические структуры). С изоморфизмом связано геохимическое поведение редких и рассеянных элементов, их распространение в горных породах и рудах, где они содержатся в виде изоморфных примесей.
Изоморфное замещение определяет многие полезные свойства искусственных материалов современной техники - полупроводников, ферромагнетиков, лазерных материалов.
Многие вещества могут образовывать кристаллические формы, имеющие различные структуру и свойства, но одинаковый состав (полиморфные модификации). Полиморфизм - способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и свойствами при одном и том же химическом составе. Это слово происходит от греческого "полиморфос " - многообразный. Явление полиморфизма было открыто М. Клапротом , который в 1798 г. обнаружил, что два разных минерала - кальцит и арагонит - имеют одинаковый химический состав СаСО 3 .
Полиморфизм простых веществ обычно называют аллотропией, в то же время понятие полиморфизма не относится к некристаллическим аллотропным формам (например, газообразным О 2 и О 3). Типичный пример полиморфных форм - модификации углерода (алмаз, лонсдейлит, графит, карбины и фуллерены), которые резко различаются по свойствам. Наиболее стабильной формой существования углерода является графит, однако и другие его модификации при обычных условиях могут сохраняться сколь угодно долго. При высоких температурах они переходят в графит. В случае алмаза это происходит при нагревании выше 1000 o С в отсутствие кислорода. Обратный переход осуществить гораздо труднее. Необходима не только высокая температура (1200-1600 o С), но и гигантское давление - до 100 тысяч атмосфер. Превращение графита в алмаз проходит легче в присутствии расплавленных металлов (железа, кобальта, хрома и других).
В случае молекулярных кристаллов полиморфизм проявляется в различной упаковке молекул в кристалле или в изменении формы молекул, а в ионных кристаллах - в различном взаимном расположении катионов и анионов. Некоторые простые и сложные вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция - шесть, нитрат аммония - четыре. Полиморфные модификации принято обозначать греческими буквами α, β, γ, δ, ε,... начиная с модификаций, устойчивых при низких температурах.
При кристаллизации из пара, раствора или расплава вещества, имеющего несколько полиморфных модификаций, сначала образуется модификация, менее устойчивая в данных условиях, которая затем превращается в более устойчивую. Например, при конденсации пара фосфора образуется белый фосфор, который в обычных условиях медленно, а при нагревании быстрее превращается в красный фосфор. При обезвоживании гидроксида свинца вначале (около 70 o С) образуется менее устойчивый при низких температурах желтый β-PbO, около 100 o С он превращается в красный α-PbO, а при 540 o С - снова в β-PbO.
Переход одной полиморфной модификации в другую называется полиморфными превращениями. Эти переходы происходят при изменении температуры или давления и сопровождаются скачкообразным изменением свойств.
Процесс перехода одной модификации в другую может быть обратимым или необратимым. Так, при нагревании белого мягкого графитоподобного вещества состава BN (нитрид бора) при 1500-1800 o С и давлении в несколько десятков атмосфер образуется его высокотемпературная модификация - боразон , по твердости близкий к алмазу. При понижении температуры и давления до значений, отвечающих обычным условиям, боразон сохраняет свою структуру. Примером обратимого перехода может служить взаимные превращения двух модификаций серы (ромбической и моноклинной) при 95 o С.
Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует, например, при переходе α-Fe в β-Fe при 769 o С структура железа не меняется, однако исчезают его ферромагнитные свойства.
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со строением вещества.
При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллыЖидкие кристаллы открыты в конце XIX века, но изучены впоследние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водянойлёдплавится при температуре выше 200 0 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т.е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решётокЛюбое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку .
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p , t ,…)существует в различных кристаллических формах (т.е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» - пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
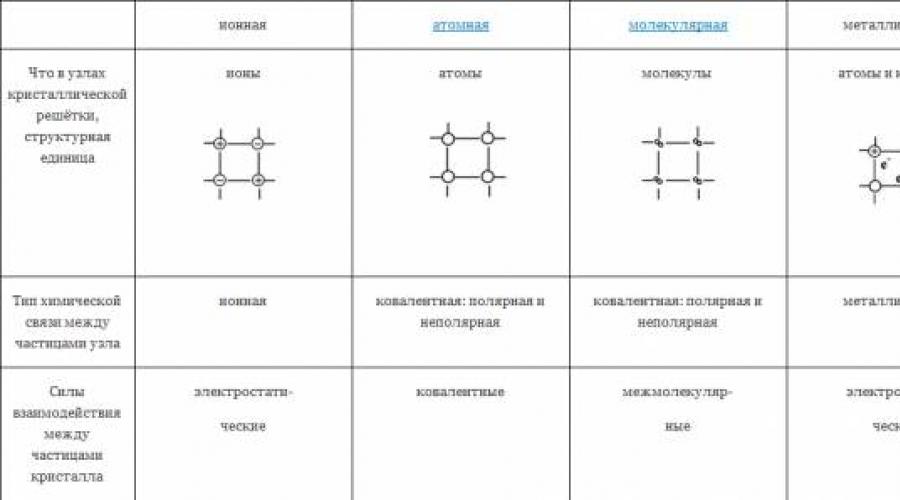
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
|
ионная |
металлическая |
|||
|
Что в узлах кристаллической решётки, структурная единица |
ионы |
атомы |
молекулы |
атомы и катионы |
|
Тип химической связи между частицами узла |
ионная |
ковалентная: полярная и неполярная |
металлическая |
|
|
Силы взаимодействия между частицами кристалла |
электростати- ческие |
ковалентные |
межмолекуляр- ные |
электростати- ческие |
|
Физические свойства, обусловленные кристаллической решёткой |
· силы притяжения между ионами велики, · Т пл. (тугоплавкте), · легко растворяются в воде, · расплав и р-р проводит эл.ток, · нелетучи (не имеют запаха) |
· ковалентные связи между атомами велики, · Т пл. и T кип очень, · в воде не растворяются, · расплав не проводит эл.ток |
· силы притяжения между молекулами невелики, · Т пл. ↓, · некоторые растворяются в воде, · обладают запахом – летучи |
· силы взаимодействия велики, · Т пл. , · Высокие тепло и электропроводность |
|
Агрегатное состояние вещества при обычных условиях |
твёрдое |
твёрдое |
твёрдое, газообразное, жидкое |
твёрдое, жидкое(Нg) |
|
Примеры |
большинство солей, щелочей, оксиды типичных металлов |
С (алмаз, графит), Si , Ge , B , SiO 2 , CaC 2 , SiC (карборунд), BN , Fe 3 C , TaC (t пл. =3800 0 С) Красный и чёрный фосфор. Оксиды некоторых металлов. |
все газы, жидкости, большинство неметаллов: инертные газы, галогены, H 2 , N 2 , O 2 , O 3 , P 4 (белый), S 8 . Водородные соединения неметаллов, оксиды неметаллов: H 2 O , CO 2 «сухой лёд». Большинство органических соединений. |
Металлы, сплавы |
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
- Взаимосвязь между положениемэлемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
|
группа |
|||||||||
|
III |
VII |
VIII |
|||||||
|
п е р и о д |
H 2 |
||||||||
|
N 2 |
O 2 |
F 2 |
|||||||
|
III |
P 4 |
S 8 |
Cl 2 |
||||||
|
Br 2 |
|||||||||
|
I 2 |
|||||||||
|
Тип кристаллическойрешётки |
металлическая |
атомная |
молекулярная |
||||||
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:
- Что такое кристаллическая решётка?
- Какие виды кристаллических решёток существуют?
- Охарактеризуйте каждый вид кристаллической решётки по плану: Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (CH 3 COOH ), сахар (C 12 H 22 O 11), калийное удобрение (KCl ), речной песок (SiO 2) – температура плавления 1710 0 C , аммиак (NH 3), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
- По формулам приведённых веществ: SiC
, CS
2 , NaBr
, C
2 H
2 - определите тип кристаллической решётки
(ионная, молекулярная) каждого соединения и на основе этого опишите физические
свойства каждого из четырёх веществ.
- Тренажёр №1. "Кристаллические решётки"
- Тренажёр №2. "Тестовые задания"
- Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a ). тугоплавки и хорошо растворимы в водеб). легкоплавки и летучи
в). Тверды и электропроводны
г). Теплопроводны и пластичны
2) Понятия «молекула»не применимо по отношению к структурной единице вещества:
a
).
вода
б). кислород
в). алмаз
г). озон
3) Атомная кристаллическая решётка характерна для:
a
).
алюминияи графита
б). серы и йода
в).
оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления,электропроводно, то его кристаллическая решётка:
а).
молекулярная
б). атомная
в). ионная
г). металлическая
Дата публикации 07.01.2013 17:01
Абсолютно любое химическое вещество, существующее в природе, образовано большим числом одинаковых частиц, которые связаны между собою. Все вещества существуют в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Когда затруднено тепловое движение (при низких температурах), а также в твердых веществах частицы строго ориентированы в пространстве, что проявляется в их точной структурной организации.
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства. В различных решетках различают межузловое пространство и непосредственно узлы – точки, в которых расположены сами частицы.
Кристаллическая решётка бывает четырех типов: металлическая, молекулярная, атомная, ионная. Типы решеток определяются в соответствии с видом частиц, расположенных в их узлах, а также характером связей между ними.
Кристаллическая решётка называется молекулярной в том случае, если в ее узлах располагаются молекулы. Они связаны между собой межмолекулярными сравнительно слабыми силами, называемые ван-дер-ваальсовыми, однако сами атомы внутри молекулы соединяются существенно более сильной ковалентной связью (полярной либо неполярной). Молекулярная кристаллическая решетка свойственна хлору, твердому водороду, двуокиси углерода и другим веществам, являющимся газообразными при обычной температуре.
Кристаллы, которые образуют благородные газы, также имеют молекулярные решетки, состоящие из одноатомных молекул. Большинство твердых органических веществ имеют именно такую структуру. Число же неорганических веществ, которым свойственна молекулярная структура, весьма невелико. Это, например, твердые галогеноводороды, природная сера, лед, твердые простые вещества и некоторые другие.
При нагревании относительно слабые межмолекулярные связи разрушаются довольно легко, поэтому вещества с такими решетками имеют очень низкие температуры плавления и малую твердость, они нерастворимы либо малорастворимы в воде, растворы их практически не проводят электрический ток, характеризуются значительной летучестью. Минимальные температуры кипения и плавления – у веществ из неполярных молекул.
Металлической называется такая кристаллическая решетка, узлы которой сформированы атомами и положительными ионами (катионами) металла со свободными валентными электронами (отцепившимися от атомов при образовании ионов), беспорядочно движущимися в объеме кристалла. Однако эти электроны по существу являются полусвободными, так как могут беспрепятственно перемещаться только в рамках, которые ограничивает данная кристаллическая решетка.
Электростатические электроны и положительные ионы металлов взаимно притягиваются, чем объясняется стабильность металлической кристаллической решетки. Совокупность свободных движущихся электронов называют электронным газом – он обеспечивает хорошую электро- и теплопроводность металлов. При появлении электрического напряжения электроны устремляются к положительной частице, участвуя в создании электрического тока и взаимодействуя с ионами.
Металлическая кристаллическая решетка характерна, главным образом, для элементарных металлов, а также для соединений различных металлов друг с другом. Основные свойства, которые присущи металлическим кристаллам(механическая прочность, летучесть, температура плавления), достаточно сильно колеблются. Однако такие физические свойства, как пластичность, ковкость, высокая электро- и теплопроводность, характерный металлический блеск свойственны лишь исключительно кристаллам с металлической решеткой.