Клетки фибробласты. Применение фибробластов в эстетической медицине
Читайте также
Тело человека состоит из триллионов разнообразных клеток. Каждый орган в нашем теле, каждая структура и квадратный сантиметр ткани насчитывает миллиарды клеток, от правильной работы которых зависит состояние всего организма. Наиболее важными клетками самого большого органа в теле человека - кожи , являются фибробласты. Их называют клетками молодости, так как именно активная работа фибробластов способствует поддержанию молодости и красоты кожи. Сегодня на сайт читайте важную информацию о фибробластах, которой обязательно должен владеть каждый специалист эстетической медицины.
Фибробласты кожи: функции и особенности строения
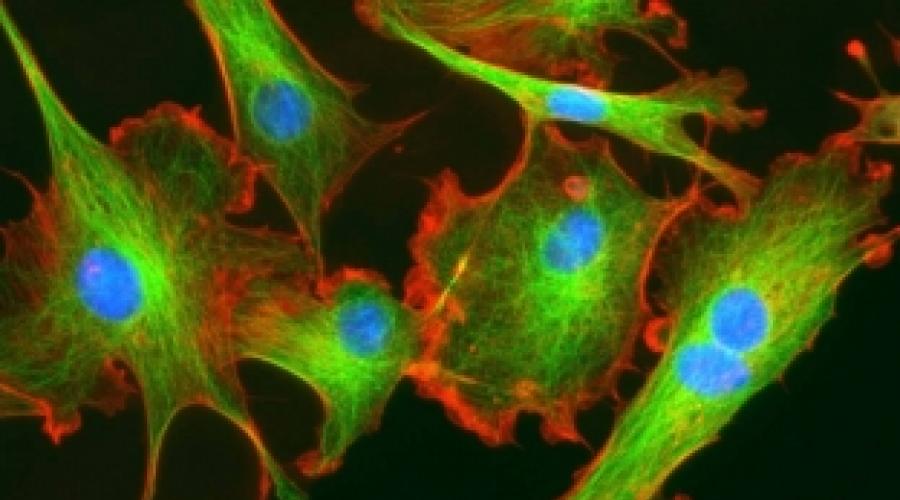
Фибробласты - это клетки соединительной ткани организма. Их предшественниками являются стволовые клетки , имеющие мезенхимное происхождение.
В организме человека фибробласты могут находиться в двух формах.
Активный фибробласт имеет большой размер, отростки, овальное ядро и много рибосом. Такая клетка может делиться и интенсивно вырабатывать коллаген. Неактивные фибробласты называются также фиброцитами. Они являются высокодифференцированными клетками, которые образовываются из фибробластов, не имеют способности к делению, но принимают активное участие в синтезе волокнистых структур и заживлении ран. Неактивные фибробласты имеют несколько меньший размер, чем активные, и отличаются веретенообразной формой.
Фибробласты:
- структурно-функциональные типы активных фибробластов;
- продукты синтеза фибробластов - компоненты внеклеточного матрикса;
- основные функции фибробластов в организме человека.
Структурно-функциональные типы активных фибробластов
Все активные фибробласты разделяются на несколько структурно-функциональных типов, каждый из которых выполняет определенные функции:
- малодифференцированные фибробласты обладают выраженными пролиферативными свойствами, то есть, они активно размножаются и растут;
- юные фибробласты - более дифференцированные клетки, которые также способны к пролиферации, но, в отличие от малодифференцированных, могут синтезировать коллаген и кислые гликозаминогликаны;
- зрелые фибробласты образуются из юных форм, практически не могут размножаться, и разделяются на три подтипа:
- фиброкласты разрушают коллаген путем фагоцитоза и внутриклеточного лизиса;
- коллагенобласты синтезируют коллаген ;
- миофибробласты играют роль в сокращении фиброзной ткани при заживлении ран.

Продукты синтеза фибробластов - компоненты внеклеточного матрикса
Фибробласты располагают в среднем слое кожи человека - в дерме . Там они вырабатывают внеклеточный матрикс, компоненты которого и формируют своеобразный каркас кожи. Основными компонентами внеклеточного матрикса являются гликопротеины, протеогликаны и гиалуроновая кислота. Широко известный коллаген, о котором знает не только каждый специалист, но и практически каждый пациент, является превалирующим гликопротеином внеклеточного матрикса. Кроме того, фибробласты продуцируют также белки фибрин, эластин, тинасцин, нидоген и ламинин, которые используются в качестве «строительных материалов» для кожи. Еще один продукт синтеза фибробластов - это факторы клеточного роста , к которым относятся:
- основной фактор, усиливающий рост всех клеток кожи;
- трансформирующий фактор, способствующий стимулированию выработки эластина и коллагена;
- эпидермальный фактор, ускоряющий деление клеток и перемещение кератиноцитов;
- фактор роста кератиноцитов.
Основные функции фибробластов в организме человека
Зная о том, что именно вырабатывают клетки дермы фибробласты, можно разобраться в широком спектре их функций, к которым относятся:
- синтез коллагена, эластина, гиалуроновой кислоты и других компонентов внеклеточного матрикса;
- формирование сосудов;
- усиление процессов клеточного роста;
- ускорение разрастания тканей;
- заживление повреждений кожи;
- направление клеток иммунной системы к бактериям и другим чужеродным агентам.
Благодаря правильной работе фибробластов, кожа человека долгие годы сохраняет свой свежий, подтянутый и молодой вид.
Только понимая основные принципы работы этих клеток, специалист может грамотно разобраться в омолаживающих методиках ..
Основное направление деятельности современной эстетической медицины - предотвращение старения при помощи высоких технологий. В результате научных исследований выявлена закономерность, заключающаяся в том, что клетки имеют способность возрождаться. Обладают этими свойствами и фибробласты, регенерация которых приводит к омоложению кожных покровов и устранению видимых дефектов на них.
Функции и природа фибробластов
Термин «фибробласты» состоит из двух латинских слов, переводимых буквально как «росток» и «волокно». По своей природе они представляют клетки соединительной ткани, синтезирующие внеклеточный матрикс (структуру ткани, которая обеспечивает перенесение химических веществ и механическую поддержку клеток кожи). Фибробласты вырабатывают вещества, которые являются предшественникам коллагеновых и эластиновых волокон, гиалуроновую кислоту, фибрин.
Происходят они из мезенхимы - зародышевой ткани, которая есть в клетках организма людей и животных. В активном состоянии структура фибропластов подразумевает наличие ядра и отростков, они имеют увеличенный размер и содержат большое количество рибосом, в состоянии покоя они уменьшаются и приобретают веретенообразную форму.
Фибробласты кожи обладают широким спектром функций. Благодаря их наличию в организме происходят следующие процессы:
- Активизация процессов синтеза коллагена и эластина.
- Формирование сосудов.
- Направление клеток иммунной системы к бактериям и чужеродным частицам.
- Ускорение разрастания тканей.
- Усиление роста клеток.
- Заживление поврежденных участков кожи.
- Выработка ряда белков (протеогликан, ламинин и другие).

Причины возрастных изменений
Молодость кожи определяется цикличным процессом выработки коллагена и эластина, которые впоследствии расщепляются на составные части, используемые фиброластами для их повторной выработки. Со временем последние снижают свою активность, переставая производить коллагеновые и эластиновые волокна, что в конечном итоге провоцирует старение кожи.
Возрастные изменения начинают проявляться уже с 28 — 30 лет. Они выражаются в потере упругости и развитии птоза, изменении цвета кожи, повышении сухости, образовании морщин. И все это в связи с тем, что каждое десятилетие фибробласты уменьшаются на 10 % от первоначального числа.
Восполнение количества фибробластов
Итак, для того чтобы замедлить старение и вернуть молодость необходимо восстановить фибробласты . Большинство современных косметологических методик приводит лишь к временному ускорению синтеза коллагеновых волокон, но не увеличивают сами клетки. Долгое время было принято считать, что это попросту невозможно.
В настоящее время наука шагнула далеко вперед, и восстановление фибробластов это уже не фантастика. Данная процедура получила название SPRS-терапия и широко практикуется в Штатах, европейских странах и с недавнего времени на территории России.
SPRS-терапия: особенности и принцип проведения
Восстановить фибробласты непросто, для этого требуется пройти через сложнейшую инъекционную процедуру. Результатами ее проведения являются утолщение кожи и повышение уровня ее эластичности, профилактика и снижение птоза. Также уменьшаются морщины, исчезает пигментация и разглаживаются рубцы.
Начинается терапия с забора клеток пациента с кожи, расположенной за ушной раковиной. Полученный образец используется для диагностики и изучения, именуется биоматериалом. Он применяется для разработки схемы лечения и искусственного воссоздания фибробластов, которые впоследствии при помощи уколов будут введены обратно в кожу.
Клетки, выращенные на основе биоматериалов пациента, не отторгаются организмом. После трансплантации они сохраняют свою активность в течение полутора лет, на протяжении которых состояние кожи улучшается.

Фибробласты не рекомендуется внедрять посредством инъекций во время обострения хронических заболеваний, при простуде, вирусных инфекциях, сопровождающихся повышенной температурой тела. Среди противопоказаний числится иммунодефицит, злокачественные образования, инфекции и хронические заболевания в острой стадии. Перед проведением процедуры обязательна предварительная консультация со специалистом для выявления индивидуальных противопоказаний.
Процедура занимает не более часа и проводится курсом из 2 сеансов с перерывом от 5 до 7 недель. Перед инъекциями обязательно проведение местной анестезии.
Внедрить фибробласты - удовольствие дорогостоящее. Полный спектр услуг, включающий забор, хранение, исследование и введение биоматериалов оценивается примерно в 400 000 рублей.
Видео: проведение SPRS терапии
Фибробласты - клетки соединительной ткани, обеспечивающие выработку коллагена и эластина, следовательно, поддерживающие молодость нашей кожи. Со временем их количество в организме неуклонно снижается, за счет чего и проявляются внешние признаки возрастных изменений. Восстановление числа фибробластов проводится посредством инъекционной методики на основе искусственно выращенных клеток.
Одно из приоритетных направлений в последние 30-40 лет - это решение вопросов коррекции возрастных изменений с помощью регенеративных биотехнологий. Оно основано на способности клеток к регенерации, то есть к самостоятельному восстановлению. Точка приложения в косметологии - кожные фибробласты. Их обновление позволяет воздействовать не только на регенерацию остальных кожных клеток и структур, но и устранять различные дефекты, в том числе и возрастные морщины. Восстанавливается не просто сама кожа, но и ее молодые свойства.
Полученную таким образом кровь можно сразу высевать в культуральную среду или если количество относительно велико, то есть более 1 мл, оставляют стоять в стоячем шприце с иглой, направленной вверх, и покрывают его пластиковым протектором, до тех пор, пока осаждение клеток крови не произойдет под действием силы тяжести. Эритроциты сначала отделены от части жидкости или плазмы, в которой лейкоциты первоначально суспендированы. Через некоторое время эти клетки склонны оседать на слое эритроцитов, образуя так называемое лейкоцитарное кольцо.
Представление о фибробластах и их функции
Фибробласты - это основные клетки соединительных тканей, происходящие от стволовых клеток мезенхимы, представляющей собой зародышевую ткань человека и животных. Они имеют ядро и характеризуются разнообразной формой, в зависимости от активности: активные клетки имеют большую величину и отростки, неактивные - веретенообразную форму и меньшие размеры.
Игла затем изогнута с помощью щипцов, и несколько капель смеси лейкоцитарной плазмы инокулируют во флакон, содержащий культуральную среду. Рисунок 2 Образец крови, полученный из гибридного катетера и жалующийся на венопункт. Культуральная среда представляет собой смесь из нескольких компонентов в водной среде , такие как аминокислоты, витамины и соль, и должна быть дополнена добавлением фетальной бычьей сыворотки, антибиотики, чтобы предотвратить бактериальное загрязнение и, прежде всего, митогенная агент, наиболее часто представленный фитогемагглютинином.
Их функция заключается в синтезе межклеточного матрикса соединительной ткани. Матрикс представляет собой ее основу, которая обеспечивает транспорт химических элементов и механическую поддержку клеток. Основными компонентами матрикса являются белки гликопротеины, среди которых превалируют, протеогликаны, эластин, фибрин и другие. Фибробласты кожи расположены в ее среднем слое. Они играют значительную роль в регенерации эпителиальных клеток, продуцируя многие факторы клеточного роста (тканевые белковые гормоны):
Хотя культуральная среда может быть подготовлена исследователем в его лаборатории, культуральные среды доступны для коммерческого использования после надлежащего добавления. Важно, однако, подчеркнуть, что выбор культуральной среды, наиболее подходящей для ее предполагаемого использования, будь то для культуры лимфоцитов или для культуры фибробластов, не всегда является простой задачей, требующей экспериментальных испытаний. Фитогемагглютинин получают из бобов, и его использование в первую очередь способствует агглютинации эритроцитов, отделяя их от лейкоцитов.
- Трансформирующий (различных типов) - способствует стимулированию синтеза коллагена и эластина, формированию мелких сосудов, а также движению фагоцитов к инородному элементу.
- Эпидермальный, ускоряющий разрастание тканей путем клеточного деления и перемещение кератиноцитов, синтезирующих кератин (пигмент).
- Основной - усиливает рост всех кожных клеток, выработку фибронектина, участвующего в защитных реакциях организма, коллагена и эластина.
- Фактор роста кератиноцитов, который способствует эпителизации и заживлению поврежденных участков кожи.
Лимфоциты, которые обычно дифференцируются в циркулирующей крови, возвращаются к лимфобластному. Как таковые, они могут размножаться один или два раза в течение 72 часов. Таким образом, это означает среднее время, указанное для содержания культур в теплице, независимо от позвоночных, хотя в конечном итоге могут быть использованы более длительные периоды. В литературе можно найти очень полезную информацию о культуральной среде, а также лучшие времена и температуры инкубации, рекомендуемые для каждой группы позвоночных.
Следующие этапы получения хромосомных препаратов состоят, как уже подчеркивалось, в лечении колхицином, продолжительность которого, а также концентрация лекарственного средства в культуральной среде могут быть переменными при гипотоническом лечении и фиксации клеток. Культуры лимфоцитов также называют кратковременными культурами, в отличие от тех, которые получены из биопсий твердых тканей, которые считаются долговечными, поскольку процесс от посадки эксплантов до создания так называемой первичной культуры и доступность клеток для первых хромосомных препаратов занимает определенное количество времени, обычно не менее 10 дней.
Фибробласты вырабатывают и продуцируют также белки:
- тинасцин, участвующий в регулировании нормального распределения коллагена и эластина в ткани;
- нидоген и ламинин (пептиды, входящие в состав базальной мембраны кожи и являющиеся для нее строительным материалом);
- протеогликаны, которые играют роль во взаимодействии клеток и другие.
Под влиянием свободных радикалов и других факторов происходит старение коллагеновых и эластиновых волокон, которые подвергаются дальнейшему расщеплению коллагеназой (вырабатывается теми же фибробластами) и эластазой на составные элементы. Их молекулы используются фибробластами для новой выработки предшественников коллагена и эластина
В общем, первый шаг - получить образец ткани, который может быть от биопсии кожи, достаточно глубоко, чтобы охватить область дермы. Для некоторых позвоночных может быть выполнена биопсия уха, крыла или хвоста, но не исключены фрагменты органа, такие как почка, печень, селезенка и легкое. Твердая тканевая культура, также называемая культурой фибробластов, требует полных условий асептики с момента закупки материалов, что должно быть сделано после точной очистки области животного, из которого будет выполняться биопсия.
Образец ткани помещают в стерильные флаконы, содержащие солевой раствор Хэнкса и антибиотик. Рекомендуется хранить материал примерно на 24 часа, слегка охлажденный в холодильнике или даже при комнатной температуре, чтобы исключить возможное загрязнение перед посевом. Биопсии часто выполняются на местах или в местах, удаленных от лаборатории исследователя, но поскольку они правильно хранятся и транспортируются, их можно без труда использовать в культуре клеток. Чтобы инициировать культуру, образец ткани разрушается ферментативной обработкой, и клеточная суспензия помещается в подходящий сосуд для культивирования.
Таким образом, функция фибробластов заключается в участии в едином замкнутом процессе разрушения-регенерации клеток и волокон.

Использование фибробластов в косметологии
Возрастные изменения тканей организма
Старение тканей - это закономерный биологический системный процесс, который начинается с 25-30 лет и затрагивает все клетки, в том числе и кожи. Одной из основных причин является снижение способности фибробластов в плане активного синтеза и пролиферации в тканях кожи, в результате чего происходит снижение содержания их главных компонентов - гиалуроновой кислоты , коллагена, эластина, сосудистой сети.
Другая альтернатива - вырезать ткань на мелкие фрагменты, распределить их. По поверхности колбы, и в этом случае эксплантаты удаляются только тогда, когда из них возникают фибробласты. Через несколько дней в теплице и ежедневном контроле условий культуральной среды фибробласты умножаются на всю свободную поверхность сосудов для культивирования. Таким образом, они образуют монослой клеток, культура готова пройти первую трипсинизацию, то есть отделение клеток и подсадки новых судов, так что число выборок достаточно велико не только для будущих препаратов хромосомных, такие как так что в ячеистом банке есть ячейки для хранения в жидком азоте.
Это отражается на внешнем виде кожного покрова. Он истончается, становится сухой, бледнеет, происходит снижение степени эластичности и упругости, замедляется восстановление жирового барьера, образуются сети мелких морщин, которые постепенно углубляются, происходит птоз кожи и формирование складок. В то же время функции катаболического (разрушительного) характера еще длительное время остаются на прежнем уровне. Ответственны за все эти изменения в основном клетки фибробласты, являющиеся одним из главных компонентов дермы. В возрасте после 30 лет их количество снижается в геометрической прогрессии каждые 10 лет на 10-15%.
Чтобы хранить клетки, образцы суспензии помещают в криогенные флаконы и, при необходимости, культуру клеток можно возобновить еще долго после. Указанное время получения хромосомных препаратов составляет около 24 часов после установления субкультур, так как оно соответствует первой волне делений клеток, которые происходят независимо от любого другого типа стимула. Колхицин затем инокулируют в культуру, а затем обрабатывают другие стадии, то есть гипотонизацию и фиксацию, необходимые для получения хромосомных препаратов.
Культура фибробластов, несомненно, является очень выгодной процедурой при работе с цитогенетикой позвоночных, особенно когда доступ к живому животному каким-то образом затруднен. Важно помнить, что для культуры фибробластов, выполняющего соответствующие физические объекты должны ламинарный поток быть асептической среде, такое оборудование, как, например, инвертированный микроскоп для контроля пролиферации клеток на поверхности культурального сосуда не всегда доступен в цитогенетических лабораториях.
Эти процессы протекают неравномерно в различных зонах кожной поверхности тела. Больше всего возрастным изменениям подвержены открытые участки и места сгибов - лицо, шея, верхние отделы грудной клетки по передней поверхности (зона «декольте»), кисти, кожа в области локтевых и лучезапястных суставов.
Биоинженерия в косметологии
Сегодня, благодаря успехам биотехнологии, появилась возможность естественным путем повлиять непосредственно на причину возрастного увядания кожных тканей. Этого удалось достигнуть способом обогащения ее собственными молодыми фибробластами, которые являются строителями внеклеточного матрикса.
Вы находите содержание этой книги интересным? Наслаждайтесь и получите свою копию сейчас. Новообразования по эволюции классифицируются как доброкачественные и злокачественные. Доброкачественные новообразования производят только локальные изменения, как правило, механического порядка, как в лейомиоме матки. В них смерть редко встречается, хотя в зависимости от топографических или функциональных факторов самого новообразования они могут быть летальными. Примеры: менингиома при сжатии головного мозга, паратиреоидная аденома гиперкальцемией.
Трансплантация в кожу лица собственных молодых клеток фибробластов способна эффективно и достаточно быстро активизировать процессы обновления и восстановления ее структуры. Результатом является улучшение цвета лица, гидратации, эластичности и тургора тканей, исчезновение мелких рубчиков, образовавшихся в результате различных кожных заболеваний, уменьшение количества и глубины морщин.
Злокачественные новообразования вызывают локальное разрушение, разрушение в отдаленных местах и общие нарушения обмена веществ. Они вызывают смерть, если к ним не относятся должным образом и в нужное время. Злокачественные новообразования в совокупности называют раком. Они являются второй причиной смертности в Чили после сердечно-сосудистых заболеваний.
Общие характеристики доброкачественных новообразований
Макроскопический и микроскопический аспект позволяет в большинстве случаев выводить, является ли новообразование доброкачественным или злокачественным.
Общие характеристики злокачественных опухолей
При злокачественных новообразованиях кожных или слизистых поверхностей некроз вызывает язвы.Преимуществом клеточного омоложения является и то, что трансплантированные фибробласты долгое время (от полугода до полутора лет) сохраняют функциональную активность в части усиленного синтеза гиалуроновой кислоты, коллагена, эластина и других компонентов матриксной системы кожи. В течение этого срока постоянно продолжается улучшение ее состояния.
Плохое разграничение, нерегулярное в соответствии с относительным сопротивлением различных тканей к инвазии: свободная соединительная ткань и просвет малых лимфатических сосудов мало сопротивляются инвазии; Артериальные стенки, кость и хрящ предлагают большую устойчивость, но их также можно вторгаться.
Вторжение было изучено лучше при злокачественных эпителиальных новообразованиях. Было установлено, что инвазия имеет критическое фазовое проникновение в основную мембрану. Были определены три этапа. Другие молекулы представляют собой интегрины, которые, связываясь с фибронектином, будут, например, ориентировать компоненты цитоскелета, изменяя форму клетки.
Клетки для трансплантации получают из кусочка кожи диаметром 3-5 мм, взятого из заушной или пупочной области, где кожа меньше всего подвержена воздействию ультрафиолетового облучения. Биоптат подвергается исследованию и специальной обработке с целью культивирования молодых фибробластов в лабораторных условиях в течение 1 месяца, после чего с помощью инъекций вводится в необходимые зоны. Аутологичные (свои) клетки не воспринимаются собственной иммунной системой как антиген (чужеродные) и, следовательно, организмом не отторгаются, а полноценно функционируют.
Неопластические клетки продуцируют три типа протеаз: сериновые протеиназы, цистеиновые протеиназы и металлопротеазы. Металлопротеиназы могут быть секретированы опухолью или чаще стромальными фибробластами при стимуляции самих опухолевых клеток. Эти же клетки секретируют ингибиторы металлопротеиназ, которые инактивируют как профермент, так и активный фермент таким образом, что протеолиз является следствием баланса между обоими действиями. Неопластические клетки продуцируют аутокринный фактор моторики, который индуцирует псевдоподии, богатые рецепторами для ламинина и фибронектина.
Нередко уже после первой процедуры аутотрансплантации наступает заметное улучшение состояния кожи, а через две недели после окончания курса процедур сами пациенты уже замечают значительное улучшение тона и контуров лица, повышение тургора и толщины кожи, уменьшение числа морщин и их глубины. Через полгода после трансплантации клеток в коже определяются их группы на фоне увеличившегося количества волокон коллагена. В течение полугода глубина морщин вокруг глаз уменьшается в среднем на 90%, в зонах «декольте» и шеи- на 95%, щек - на 87%, вокруг рта - на 55%.
Выявлены хемотаксические и гаптотактические факторы, которые увеличивают подвижность клеток. Клетки перемещаются в амебоидной форме, подобной лейкоцитам. Молекулярные механизмы, контролирующие подвижность и биохимический контроль сборки цитоскелета, неизвестны. Оттуда он может продолжаться через лимфатические сосуды и распространяться на ганглии или отдаленные органы. Частным примером является диффузное лимфатическое проникновение легкого или карциноматозного лимфангиоза, при котором междольковые легочные перегородки появляются увеличенными, а плевра проявляет очень заметную молочную сетчатку из-за утолщения лимфатических сосудов.

Введение полученного материала в дерму осуществляется тоннельным способом под местной анестезией посредством нанесения крема с анестетиками на кожу. Курс лечения состоит из 2-х процедур с интервалом 1-1,5 месяца. После введения фибробластов они распределяются в дермальном слое небольшими группами и не подвержены митотическому делению, что исключает процессы перерождения их в опухолевые клетки.
Примеры: портальная вена при раке печени, нижняя кава при раке почки. Несмотря на то, что они сходны с тканями происхождения, те, которые имеют злокачественную опухоль, представляют собой вариации. Эти вариации встречаются в паренхимных клетках одного и того же новообразования и в клетках разных новообразований того же типа. Подобно тому, как неоплазия представляет собой карикатуру на оригинальную ткань, ее клетки являются карикатурой на нормальные клетки.
Персонажи клеточной гетеротипии
Ячейка в целом показывает анизоцитоз или изменения размеров. Цитоплазма, как правило, более редкая и базофильная, иногда обильная и с ненормальной дифференциацией. В некоторых раках молекулы, которые обычно обнаруживаются только в эмбриональной или плодовой жизни, появляются в цитоплазме.
Препараты для трансплантации проходят лабораторный контроль на предмет биологической безопасности и жизнеспособности клеток. Методика аутотрансплантации фибробластов в косметологии получила официальное разрешение Росздравнадзора.
Современная косметология располагает целым спектром техник и методик, способных существенно омолодить кожу лица. Стоит, правда, отметить, что почти все ныне существующие методы способны омолаживать кожу лишь на время, совершенно не влияя на биологические процессы, происходящие в клетках. Но мы знаем, что старение начинается на клеточном уровне и разумно воздействовать именно на клетки, чтоб обратить этот процесс вспять. Поэтому в косметологии существуют регенеративные технологии, которые опираются на инволюционные биотехнологии. Главным инструментом регенеративных технологий являются фибробласты.
Ядро вообще уникально, иногда двойное или множественное. Показывает анизокариоз или переменные размеры, полиморфизм или округлые до крайне нерегулярных ядер. Ядерная граница нерегулярно распилена или сгибается, и часто возникает гиперхромазия, то есть хроматин в зернах или грубых комках, прикрепленных к ядерной границе.
Ядро является однократным и увеличивается по размеру и нерегулярно. Митотические фигуры могут быть аномальными с триполярными или тетраполярными веретенами или с анархической дисперсией хромосом. Изменения, описанные как компоненты гетеротипии, могут быть сгруппированы в две группы: одна из анаплазии; другой, который мы можем назвать чудовищем.
ВАЖНО!
Фибробласты – это клетки соединительной ткани, которые синтезируют межклеточный матрикс. Фибробласты выделяют предшественников коллагена и эластина, а также гликозаминогликанов, самая известная из которых – гиалуроновая кислота. Фибробласты являются зародышевой тканью как у человека, так и у животных. Фибробласты имеют разнообразную форму, в зависимости от местонахождения в организме и от уровня своей активности. Слово «фибробласты произошли от латинского корня «фибра» – волокно и греческого «бластос» – зародыш.
Функции фибробластов
Основная роль фибробластов в организме – синтез компонентов внеклеточного матрикса:
- белков (коллагена и эластина), которые образуют фиброволокна;
- мукополисахаридов (аморфное вещество).
В коже фибробласты отвечают за процесс ее восстановления и обновления. Они синтезируют коллаген и эластин – основной каркас кожи и гиалуроновую кислоту, связывающую в тканях воду. Другими словами, именно фибробласты являются генераторами молодости и красоты нашей кожи. С годами число фибробластов уменьшает, а оставшиеся фибробласты теряют свою активность. По этой причине темпы регенерации кожных покровов снижаются, коллаген и эластин теряют свою упорядоченную структуру, в результате чего появляется больше поврежденных волокон, неспособных выполнять свои прямые функции. В итоге, наступает возрастное увядание кожи: дряблость, сухость, потеря объемов и появление морщин.
Под влиянием Уф-излучения в коже образуются свободные радикалы, разрушающие коллагеновые и эластические волокна. Но не только свободные радикалы разрушают коллаген и эластин. В процессе разрушения коллагена и эластина также задействованы ферменты коллагеназа и эластаза, которые тоже синтезируются фибробластами. Ферменты расщепляют волокна белков на основные компоненты, из которых затем фибробласты вырабатывают предшественников коллагена и эластина.
Можно сказать, что фибробласты играют ключевую роль в процессе круговорота деградации и синтеза клеток и волокон.
Еще раз назовем основные функции фибробластов в организме:
- способствуют эпителизации и заживлению поврежденной кожи за счет стимуляции кератиноцитов;
- ускоряют пролиферацию и дифференцировку клеток;
- играют большую роль в заживлении ран, способствуют перемещению фагоцитов;
- синтезируют коллаген, эластин и гиалуроновую кислоту;
- участвуют в процессах регенерации и обновления кожных покровов.
Как активизировать фибробласты?
Выше мы узнали, каковы причины старения организма, и какую роль в этом процессе играют фибробласты. И тут рождается вполне закономерный вопрос: как активизировать фибробласты? Ведь с возрастом их количество не просто снижается, даже если количество фибробластов остается прежним, они становятся пассивными и полностью теряют свою активность. Задача регенеративных биотехнологий найти способы воздействия на фибробласты, чтоб заставить их «вспомнить молодость». Есть ли успехи в этом направлении? С уверенностью можно сказать, что да.

Восполнение в кожи белков молодости – коллагена и эластина – инъекционным методом не дает надежных результатов омоложения. Они способны улучшить характеристики кожи лишь на некоторое время. То есть состояние кожи становится лучше, но процесс старения не приостановлен, биологические часы неумолимо идут вперед. И через некоторое время, после деградации коллагена, эластина и гиалуроновой кислоты, состояние кожи оставляет желать лучшего.
Лучшее средство омоложения – это наша естественная система обновления и регенерации. Стимуляция собственных ресурсов организма – вот ключ к нашей молодости. На данный момент существуют регенеративные биотехнологии, способные действительно омолодить организм. Главенствующая роль в этих методиках отводится фибробластам.
Современные регенеративные технологии
В основе современных регенеративных технологий стоит принцип стимуляции аутологичных дермальных фибробластов. Суть этих технологий заключается в пополнении популяции фибробластов молодыми и активными клетками. Этот метод называется SPRS-терапия, что буквально обозначает service for personal regeneration of skin (сервис для индивидуального восстановления кожи).
Как же это происходит? Из кусочка кожи путем определенных лабораторных манипуляций выделяют фибробласты. Отбору и стимуляции подвергаются только молодые и активные фибробласты. Затем их популяция в течение некоторого времени доводится до нужных объемов, и они готовы для внедрения в организм. При внедрении аутологичных (собственных) фибробластов не наблюдается отторжений и аллергических реакций, так как в организм поступают свои собственные клетки. Новые фибробласты способны регенерировать кожные покровы в течение двух лет и даже больше. Результат заметен сразу же после первого сеанса клеточной терапии. Происходит заметное улучшение кожных покровов: исчезает дряблость и сухость, улучшается цвет лица и структура кожи, полностью исчезают мелкие морщины, а глубокие становятся менее заметными.
Фибробласты, стволовые клетки и онкогенез
Многие пациенты отождествляют фибробласты со стволовыми клетками. Поэтому часто задают вопрос, не являются ли фибробласты стволовыми клетками? Нет, нет и еще раз нет. Фибробласты не имеют никакого отношения к стволовым клеткам, использование которых, к слову сказать, запрещено во всем мире. Фибробласты относятся к зрелым, специализированным для определенной ткани клеткам. Они способны превратиться только в фиброциты. Фиброциты – это тоже клетки соединительной ткани, которые не способны делиться. Стволовые клетки – это незрелые, недифференцированные клетки, которые могут дать начало нескольким типам клетки и из которых можно вырастить любую ткань нашего организма.
СТРОЙНАЯ ФИГУРА!

Другой вопрос, часто задаваемый пациентами, способны ли аутологичные фибробласты переродиться в опухолевые клетки? Это совершенно невозможно. Фибробласты не способны переродится в злокачественные клетки, потому что они не поддаются непрямому делению клеток (митозу). Они запрограммированы на определенное количество делений, после чего погибают, а их место занимают новые клетки. После внедрения в кожу фибробласты не делятся, но продолжительное время вырабатывают необходимые вещества, способствующие регенерации и омоложению кожи. Таким образом, они остаются совершенно безопасными аутологичными фибробластами как в процессе культивирования в лаборатории, так и в процессе внедрения в организм.
Культивированные аутологичные фибробласты подвергаются строгому контролю на предмет биологической безопасности и жизнеспособности клеток.
Вы – одна из тех миллионов женщин, которые борются с лишним весом?
А все ваши попытки похудеть не увенчались успехом?
И вы уже задумывались о радикальных мерах? Оно и понятно, ведь стройная фигура - это показатель здоровья и повод для гордости. Кроме того, это как минимум долголетие человека. А то, что человек, теряющий «лишние килограммы» , выглядит моложе – аксиома не требующая доказательств.
Владельцы патента RU 2536992:
Изобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано в медицине. Способ включает масштабирование диплоидных клеток линии М-20 из криобанка ИПВЭ им. М.П. Чумакова РАМН из ампулы банка посевных клеток 7 пассажа с получением банка рабочих клеток 16 пассажа. При этом клетки 20-33 пассажей, пригодные для использования в лечебных и/или диагностических целях, получают путем культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека, содержащей тромбоцитарный фактор роста PDGF в концентрации от 155 до 342 пг/мл. Изобретение позволяет повысить пролиферативную активность диплоидных клеток фибробластов человека. 1 з.п. ф-лы, 2 табл.
Изобретение относится к биотехнологии, иммунологии, медицине, в частности к способу повышения пролиферативных свойств диплоидных клеток фибробластов человека для использования таких клеток в лечебных и диагностических целях, в том числе для определения антивирусной активности интерферонов человека, для заместительной клеточной терапии.
Линии диплоидных клеток человека (ЛДКЧ) обладают неоспоримыми преимуществами перед всеми известными видами клеточных культур своей способностью сохранять в пассажах стабильные биологические и генетические характеристики. Аттестацию ЛДКЧ, предназначенных для производства вакцин, проводят в соответствии с едиными требованиями, разработанными Всемирной организацией здравоохранения . Эти рекомендации взяты за основу национальных критериев аттестации вакцинных ЛДКЧ, разработанных ГНИИСиК МИБП им. Л.А. Тарасевича и МЗ СССР [Методические рекомендации «Аттестация перевиваемых клеточных линий - субстратов производства и контроля медицинских иммунобиологических препаратов» РД-42-28-10-89. МЗ СССР. М., 1989. - С. 16]. Аттестованная линия диплоидных клеток человека имеет ограниченный срок жизни и обладает стабильными биологическими, культуральными и генетическими характеристиками, она свободна от контаминантов (бактерий, грибов, микоплазм, вирусов) и не вызывает образования опухолей у иммуносупрессированных животных. Линия диплоидных клеток должна иметь аттестованный банк посевных клеток на ранних уровнях пассажей (до 10 пассажа), состоящий не менее чем из 200 криопробирок. При пассировании посевных клеток из одной или нескольких криопробирок до уровня 16 пассажа получают рабочий банк клеток, из которого могут быть получены необходимые культуры-продуценты для производства или для исследовательской работы. В России и за рубежом существуют всего несколько линий диплоидных клеток человека (Wi-38, MRC-5, М-22 и др.), аттестованных согласно перечисленным требованиям. Аттестованные ЛДКЧ используют при изгототовлении вакцин против полиомиелита, кори, краснухи, бешенства, респираторной и цитомегаловирусной инфекций, а также интерферона [Т.К. Борисова, Л.Л. Миронова, О.И. Конюшко, В.Д. Попова, В.П. Грачев, Н.Р. Шухмина, В.В. Зверев. Отечественные штаммы диплоидных клеток человека - субстрат для производства вакцин. Медицинская вирусология. Материалы научно-практической конференции «Актуальные проблемы медицинской вирусологии, посвященной 100-летию М.П. Чумакова». М. 2009. Том XXVI. С. 305-307; Л.Л. Миронова, В.Д. Попова, О.И. Конюшко. Опыт создания банка авторских линий перевиваемых клеток и их применение в вирусологической практике. Биотехнология. 2000, с. 41-47]. ЛДКЧ широко применяются in vitro для диагностики вирусных инфекций, анализа токсичности различных препаратов и изделий, для заместительной терапии [Патент РФ №2373944, 23.06.2008. Способ лечения ожоговой раны. А.С. Ермолов, С.В. Смирнов, В.Б. Хватов, Л.Л. Миронова; С.В. Смирнов, В.Б. Хватов. Инновационные технологии местного лечения ожогов в НИИ скорой помощи им. Н.В. Склифосовского. В книге: Новая экономика. Инновационный портрет России. М., Центр стратегического партнерства, 2009. С. 388-390].
В ИПВЭ им. М.П. Чумакова РАМН в 80-х годах 20 века было установлено несколько линий диплоидных клеток из кожи и мышц 8-10 недельных эмбрионов человека. Настоящая работа посвящена модификации производства диплоидных клеток человека для диагностических целей и заместительной клеточной терапии, а именно получению диплоидных клеток фибробластов человека с повышенными пролиферативными свойствами.
Прототип. Патент РФ №1440029 от 22.03.93 г. [Миронова Л.Л., Преображенская Н.К., Соловьева М.Н., Орлова Т.Г. Стобецкий В.И., Крючкова Г.П., Кармышева В.Я., Кудинова С.И., Попова В.Д., Алпатова Г.А. ИПВЭ и НИИЭиМ им. Н.Ф. Гамалеи. Штамм диплоидных клеток кожи и мышц эмбриона человека, используемый в качестве тест-системы для определения антивирусной активности интерферонов человека и размножения вирусов].
Этот штамм ЛДКЧ обозначен М-21, однако культура фибробластов М-21 обладала недостаточной пролиферативной активностью, что снижало время образования монослоя и повышало расход клеток и материалов, и это, в конечном итоге, привело к полному истощению ее запасов. В результате возникла необходимость в новой клеточной линии, пригодной для определения антивирусной активности интерферонов человека и других медико-биологических целей, более экономически выгодной, отличающейся высокой пролиферативной активностью, имеющей банки посевных и рабочих клеток. Эта линия обозначена М-20. На уровне 7 пассажа изготовлен банк посевных клеток. В 2012 году из ампулы банка 7 пассажа изготовлен банк рабочих клеток на уровне 16 пассажа. Банки посевных и рабочих клеток на уровнях 7 и 16 пассажей хранятся в ИПВЭ им. М.П. Чумакова РАМН и позволяют обеспечить как производственные процессы, так и научные исследования.
Отличием настоящего изобретения от ближайшего аналога (прототипа) является повышение пролиферативной активности клеток линии М-20 при использовании 10% фибринолитически активной плазмы (ФАП).
Таким образом, объектом изобретения является способ повышения пролиферативных свойств диплоидных клеток фибробластов человека для медико-биологических целей посредством культивирования клеток из криобанка ИПВЭ им. М.П. Чумакова РАМН, в котором используют диплоидные клетки охарактеризованной линии М-20, которые масштабируют из ампулы банка посевных клеток 7 пассажа и получают банк рабочих клеток 16 пассажа, при этом клетки 20-33 пассажей, пригодные для использования в лечебных и/или диагностических целях, получают путем культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека. При культивировании клеток используют, предпочтительно, питательную среду ДМЕМ с 10% ФАП.
Диплоидные клетки человека охарактеризованной линии М-20, получаемые вышеуказанным способом, обладают высокой пролиферативной активностью и пригодны для использования в лечебных и/или диагностических целях.
Схема осуществления способа:
1. Используется одна криопробирка из банка посевных клеток 7 пассажа ИПВЭ им. М.П. Чумакова РАМН
2. Приготовление банка рабочих клеток на уровне 16 пассажа ИПВЭ им. М.П. Чумакова РАМН
3. Восстановление фибробластов линии М-20 из банка рабочих клеток 16 пассажа (ИПВЭ им. М.П. Чумакова РАМН).
4. Получение монослойной культуры фибробластов линии М-20, 17 пассаж.
5. Восстановление биологических свойств фибробластов линии М-20 путем трехкратного пассирования (до 20 пассажа включительно) для репарации возможных повреждений ДНК в процессе криоконсервирования.
6. Получение культур клеток для диагностических целей и заместительной клеточной терапии тиражированием фибробластов линии М-20 с 20 по 33 пассаж с использованием питательной среды, содержащей 10% фибринолитически активной плазмы (с содержанием PDGF от 155 до 342 пг/мл).
Предлагаемый способ обеспечивает получение клеток, обладающих высокой пролиферативной активностью и пригодных для использования в диагностических и/или лечебных целях.
Данный технический результат достигается культивированием фибробластов человека линии М-20 в питательной среде с добавлением 10 % фибринолитически активной плазмы (ФАП), обладающей ростстимулирующим действием и обеспечивающей усиление пролиферативной активности культуры клеток.
ФАП - клинически используемая трансфузионная среда, которую получают из крови внезапно умерших от инфаркта миокарда, острой сердечной недостаточности, кровоизлияния в головной мозг, в первые 6 часов после смерти [приказ МЗ СССР №482 от 14.06.1972 года «Об улучшении обеспечения лечебно-профилактических учреждений и клиник трупными тканями, костным мозгом и кровью»]. Посмертная кровь является полноценной трансфузионной средой, имеющей ряд биологических свойств - в первую очередь повышенный фибринолитический потенциал. В этой связи посмертную кровь предложено также называть фибринолизной. Основные показания к переливанию посмертной крови: острая кровопотеря, шок, анемия различного происхождения, ожоговая травма, обменное замещение при экзогенных отравлениях, заполнение АИКа при использовании экстракорпорального кровоообращения в хирургии [Е.Г. Цуринова. Переливание фибринолизной крови. М., 1960, 159 с; С.В. Рыжков. Заготовка и возможности использования фибринолизной крови в зависимости от срока взятия и причины смерти. Автореф. докт. дисс. Л., 1968, 21 с.; Г.А. Пафомов. Биологическая характеристика крови внезапно умерших и ее использование в хирургической практике. Дисс. докт. мед. Наук. М., 1971, 355 с.; К.С. Симонян, К.П. Гутионтова, Е.Г. Цуринова. Посмертная кровь в аспекте трансфузиологии. М., Медицина, 1975, 271 с.]. В настоящее время используются компоненты посмертной крови: фибринолитически активная плазма, эритроцитная масса, лейкоцитная масса, тромбоцитная масса [Г.Я. Левин. Гемокоагуляционные свойства и клиническое применение плазмы и тромбоцитов кадаверной крови. Автореф. докт. дисс. М., 1978, 31 с; В.Б. Хватов. Препараты фибринолитического и антипротеназного действия из плазмы крови внезапно умерших людей. Дисс. докт. мед наук, 1984, 417 с.; V.B. Khvatov Plasmakinase - a new thrombolytic preparation from postmortem plasma In: Thrombosis and Thrombolysis edd. E.I. Chazov, V.V. Smirnov). Consultants Bureau, N.Y., L, 1986, p. 283-310; В.Б. Хватов. Медико-биологические аспекты использования посмертной крови. Вестник АМН СССР, 1991, 9. С. 18-24; В.Б. Хватов. Трупная кровь - история и современное состояние вопроса. Пробл. гематол. и перелив. крови, 1997, 1. С. 51-59]. Компоненты трупной крови, получаемые от доноров органов, также получили клиническое применение [погибший индивидуум с бьющимся сердцем согласно “Инструкции по констатации смерти человека на основании диагноза смерти мозга» от 20.12.2001 г. №460, регистрация Минюста №3170 от 17 января 2002]. Трансплантация органов, тканей и клеток осуществляется согласно Закону РФ «О трансплантации органов и (или) тканей человека» - в ред. Федеральных законов от 20.06.2000 №91-Ф3, от 16.10.2006 №160-Ф3; В.Б. Хватов, С.В. Журавель, В.А. Гуляев, Е.Н. Кобзева, М.С. Макаров. Биологическая полноценность и функциональная активность клеточных компонентов крови доноров органов. Трансплантология, 2011, 4, с. 13-19; Хубутия М.Ш., Хватов В.Б., Гуляев В.А. и др. Способ компенсации глобулярного объема крови и иммуномодулирующего воздействия при трансплантации. Патент РФ на изобретение №2452519, опубл. 10.06.2012, бюл. №16].
Фибринолитически активную плазму получают из крови внезапно умерших людей, заготовленной на консерванте Глюгицир (соотношение кровь: консервант 4:1) для сохранения ее фибринолитически активных свойств. Отделение плазмы от клеточных элементов крови производят в стерильном боксе с соблюдением всех правил асептики и антисептики и аналогично получению донорской плазмы из консервированной донорской крови. Клиническое использование ФАП в хирургии и травматологии выявило эффект стимуляции заживления ран [И.Ю. Клюквин, М.В. Звездина, В.Б. Хватов, Ф.А. Бурдыга. Способ лечения укушенных ран. Патент на изобретение РФ №2372927, опубл., 20.11.2009, бюлл. №32]. Этот эффект мы связывали с присутствием ростстимулирующих факторов в ФАП, выделяемых активированными тромбоцитами. В дальнейшем в ФАП нами идентифицирован тромбоцитарный фактор роста (PDGF). Ростстимулирующее действие ФАП в культуре клеток человека показано в специальных исследованиях. В клеточную суспензию фибробластов человека линии М-20, содержащую известное количество клеток, добавляли исследуемые образцы ФАП в 10% концентрации и по 10 мл полученной смеси помещали в культуральные флаконы с площадью ростовой поверхности 25 см 2 . Клетки выращивали в течение 3-4 суток при содержании в атмосфере 5% CO 2 и при 37°C. После 3-кратного пассирования проводили подсчет выросших клеток в камере Фукс-Розенталя и определяли отношение числа выросших клеток к числу посаженных - индекс пролиферации (в таблице 1).
Из проведенных опытов следует, что ростовые свойства ФАП обеспечивают высокую пролиферативную активность и не отличаются от таковой эмбриональной сыворотки крупного рогатого скота. При этом ФАП содержит ростовые факторы тромбоцитов человека, т.е. аллогенного типа, в отличие от эмбриональной сыворотки крупного рогатого скота - ксеногенного типа. Этот факт является определяющим при трансплантации клеток при заместительной терапии. Отметим, что ростстимулирующее действие на культуру клеток линии М-20 обусловлено, в частности, наличием в ФАП PDGF в концентрации от 155 до 342 пг/мл. Эти данные получены с помощью набора реагентов «Qantikine, Human PDGF-BB Immunoassay» фирмы «R & D Systems» и системы «Multiskan ascent» фирмы «Thermo». Концентрация PDGF-BB в ФАП сходна с его содержанием в сыворотке крови. Так в сыворотке доноров крови и обследованных пациентов содержание PDGF составило от 110 до 880 пг/л, в среднем 244 пг/мл, тогда как в плазме содержание PDGF варьировало от 0-2 пг/мл.
Для лучшего понимания предлагаемого технического решения «производство диплоидных клеток человека линии М-20 для медико-биологических целей» приводим следующий пример.
Клетки линии М-20 16 пассажа восстанавливают из рабочего банка. Для этого криопробирку с клетками извлекают из жидкого азота и помещают в водяную баню при температуре 38°C и после оттаивания содержимое переносят в культуральный сосуд с питательной средой ДМЕМ, содержащей 10% ФАП (с содержанием PDGF от 155 до 342 пг/мл), добавляют антибиотик гентамицин из расчета 1 мл 4% раствора на 1 л питательной среды. Для формирования монослоя клетки культивируют в течение 4-5 суток при 37°C и содержании CO 2 в атмосфере 5%. После формирования монослоя клеток проводят 3 последовательных пассажа, необходимых для репарации ДНК после криоконсервирования. Затем проводят тиражирование клеток с 20 по 33 пассаж. Клетки этих пассажей предназначены для медико-биологических целей. Полученная линия клеток подробно охарактеризована в соответствии с требованиями ВОЗ и ГНИИСиК МИБП им. Л.А. Тарасевича, включая HLA-типирование клеток линии М-20, а также проведено изучение ее цитокинового спектра. Приводим сравнительную характеристику свойств линии М-20 и линии М-22 (таблица 2). Линия М 22 (диплоидные фибробласты человека) лицензирована в качестве вакцинного субстрата и разрешена для производства любых видов медицинских вирусных вакцин, а также применена для лечения ожоговых ран II-IIIA степени [Патент РФ на изобретение №2373944, 23.06.2008. Способ лечения ожоговой раны. А.С. Ермолов, С.В. Смирнов, В.Б. Хватов, Л.Л. Миронова, О.И. Клнюшко, Е.А. Жиркова, B.C. Бочарова].
Линия М-20 установлена в ИПВЭ им. М.П. Чумакова РАМН в 1986 году из кожи и мышц 10-недельного эмбриона человека, полученного в результате аборта от здоровой женщины. Онкологических, венерических заболеваний, гепатита, туберкулеза в анамнезе не обнаружено; генетических и врожденных заболеваний в семье не наблюдалось. Среда культивирования клеток ДМЕМ с добавлением 10% ФАП. Коэффициент рассева 1:3-1:4 дважды в неделю при посевной дозе клеток 7×10 4 кл/мл. Клеточный монослой состоит из ориентированных однородных веретеновидных клеток с овальными ядрами, содержащими 1-3 ядрышка и мелкие глыбки хроматина. В жизненном цикле линии можно выделить 3 фазы развития: становление 1-3 пассажи, активный рост 4-40 и старение 41-52, затем наступала гибель. Клетки линии имеют кариотип человека 2т=46, ХУ. Линия характеризуется высокой генетической стабильностью: 93,3-96,9% клеток имеют диплоидный набор хромосом, клеток с полиплоидным набором не более 1,6%. Пробелов и разрывов, а также кольцевых хромосом не наблюдали. Количество полос изоэнзимов Г-6ФДЕ и ЛДЕ и их электрофоретическая подвижность совпадают с таковыми для эритроцитов человека. Г-6ФДГ медленного типа. При посеве на селективные питательные среды контаминации бактериями, грибами, микоплазмами не обнаружено. Кроме этого контаминации микоплазмами не выявлено при окраске ДНК-флуорохромами Hochst 33258 и оливомицином, а также методом ПЦР. Контаминации вирусами в опытах на сосунках и взрослых белых мышах, морских свинках, кроликах и куриных эмбрионах, а также на гомологичных и гетерологичных культурах клеток не обнаружено. Контроль туморогенности. При введении клеток линии иммунодепрессированным животным опухоли не образовывались. Обратной транскриптазы не обнаружено. HLA-маркеры: Класс I: A*(02.03)/B*(07.40)/CW*(03.07). Класс II: DRB1*(15.16)/DQB1*(05.06). Клетки линии М-20 на уровне 20 пассажа продуцируют мРНК α-интерферона (ИФНα) и интерлейкинов: ИЛ1β, 2, 4, 6, 8, 10, 18.
Таким образом, предлагаемая линия является диплоидной - обладает ограниченным сроком жизни, сохраняет кариотип нормальных клеток человека на протяжении всей жизни, свободна от контаминантов и не обладает онкогенными потенциями. Она охарактеризована на безопасность в соответствии с рекомендациями ВОЗ и требованиями ГНИИСиК МИБП им. Л.А. Тарасевича. В ИПВЭ им. М.П. Чумакова РАМН имеются банки посевных и рабочих клеток, способные обеспечить все потребности производства и научных исследований. Клетки линии М-20 чувствительны к заражению различными вирусами. Дополнительно изучен цитокиновый спектр линии М-20. Знание цитокинового спектра клеток позволяет более точно оценивать результаты при определении интерферонового статуса больных и давать обоснованные рекомендации по применению лечебно-профилактических препаратов.
Диплоидные клетки человека - фибробласты штамма М-20 с повышенной пролиферативной активностью, получаемые предлагаемым способом, могут быть использованы для диагностических целей, в частности для определения активности интерферона (ИФН) в сыворотке крови человека, а также в лечебных целях, например для местного лечения пролежней, укушенных ран, длительно не заживающих и ожоговых ран.


1. Способ повышения пролиферативных свойств диплоидных клеток фибробластов человека, отличающийся тем, что диплоидные клетки охарактеризованной линии М-20 из криобанка ИПВЭ им. М.П. Чумакова РАМН масштабируют из ампулы банка посевных клеток 7 пассажа и получают банк рабочих клеток 16 пассажа, при этом клетки 20-33 пассажей, пригодные для использования в лечебных и/или диагностических целях, получают путем культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека, содержащей тромбоцитарный фактор роста PDGF в концентрации от 155 до 342 пг/мл.
2. Способ по п.1, в котором при культивировании клеток используют питательную среду ДМЕМ с 10% ФАП.
Похожие патенты:
Изобретение относится к фармацевтической промышленности, а именно к применению клеток плацентарного перфузата человека в получении лекарственного средства для подавления пролиферации опухолевых клеток у индивида.
Группа изобретений относится к области биотехнологии и онкологии. Способ предусматривает: а) выделение постнатальных тканеспецифичных мультипотентных аутологичных стволовых клеток (АСК) и/или аутологичных прогениторных клеток (АПК) для их последующего протеомного и полнотранскриптомного анализов; б) выделение АСК и/или АПК и/или мультипотентных аллогенных HLA-гаплоидентичных стволовых клеток (HLA-CK) для последующего ремоделирования их протеомного профиля; в) выделение РСК из опухоли пациента; г) протеомный анализ АСК и/или АПК и РСК; д) полнотранскриптомный анализ АСК и/или АПК и РСК; е) определение набора белков, каждый из которых содержится в протеомных профилях как АСК и/или АПК, так и РСК; ж) анализ ранее определенного набора белков для идентификации в РСК внутриклеточных сигнальных путей, не подвергшихся неопластической трансформации в результате канцерогенеза, и определения белков-мишеней, являющихся мембранными акцепторами идентифицированных сигнальных путей; з) анализ полнотранскриптомного профиля экспрессии генов РСК и подтверждение сохранности и функциональной значимости структурных компонентов идентифицированных сигнальных путей в РСК; и) определение белков-лигандов, способных активировать белки-мишени; к) сравнительный анализ полнотранскриптомных профилей АСК и/или АПК с транскриптомными профилями, содержащимися в известных базах данных транскриптомов, для определения пертурбогенов, способных модифицировать профиль экспрессии генов АСК и/или АПК и/или HLA-CK, выделенных для ремоделирования их протеомного профиля, в направлении секреции ранее определенных белков-лигандов; л) ремоделирование протеомного профиля АСК и/или АПК и/или HLA-CK пертурбогенами с получением модифицированного транскриптомного профиля различных клеточных систем, способных оказывать регуляторное воздействие на РСК пациента.
Изобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано в медицине. Популяцию мононуклеарных клеток или неэмбриональных стволовых клеток, обогащенную клетками моноцитарной линии дифференцировки, содержащей промоноциты, применяют для лечения ишемии у субъекта.
Изобретение относится к области биотехнологии и клеточной технологии. Заявленное изобретение направлено на создание плюрипотентных, мультипотентных и/или самообновляющихся клеток, которые способны начать дифференцироваться в культуре в различные типы клеток и способны к дальнейшей дифференцировке in vivo.
Изобретение относится к области медицины и может быть использовано для отбора сперматозоидов в методах вспомогательных репродуктивных технологий. Способ предусматривает размещение в чашке Петри капли спермы и капли культуральной среды на расстоянии друг от друга не более 5 см, соединение капель полосой из вязкой среды с параметрами вязкости 1-4 Па·с, затем инкубируют чашку с содержимым в течение 30-90 мин в условиях, моделирующих естественную среду цервикального канала женского репродуктивного тракта.
Изобретение относится к области медицины, биотехнологии и клеточных технологий. Способ дифференцирования плюрипотентных стволовых клеток, представляющих собой линию клеток человека, в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы, включает обработку плюрипотентных стволовых клеток средой, отличающейся тем, что она не содержит активин А и содержит GDF-8, в течение периода времени, достаточного для того, чтобы плюрипотентные стволовые клетки дифференцировались в клетки, экспрессирующие маркеры, характерные для линии сформированной эндодермы.
Настоящее изобретение относится к области иммунологии. Предложены варианты олигопептида, выделенные из белка RAB6KIFL (KIFL20A), которые способны индуцировать цитотоксические Т-лимфоциты (CTL) в составе комплекса с молекулой HLA-A*0201.
Изобретение относится к области пищевой промышленности и представляет собой способ пивоварения, включающий добавление к суслу термостабильной протеазы после фильтрации сусла, но перед варкой сусла, причем термостабильность протеазы означает, что активность этой протеазы составляет по меньшей мере 70% ее активности, измеренной согласно следующему методу: протеазу разводят до концентрации 1 мг/мл в аналитическом буфере, содержащем 100 ммоль сукциновой кислоты, 100 ммоль HEPES, 100 ммоль CHES, 100 ммоль CABS, 1 ммоль СаСl2, 150 ммоль КСl, 0,01% Тритон Х-100, и с рН, доведенным до 5,5 с помощью NaOH; после чего протеазу преинкубируют i) во льду и ii) 10 мин при 70°С; субстрат, к которому протеаза проявляет активность, суспендируют в 0,01% Тритоне Х-100: для начала реакции в пробирку добавляют 20 мкл протеазы и инкубируют в термомиксере Эппендорфа при 70°С, 1400 об/мин в течение 15 минут; реакцию останавливают помещением пробирок в лед; образцы центрифугируют холодными при 14000 g в течение 3 минут и измеряют оптическую плотность OD590 супернатанта; полученное значение OD590 образцов без протеазы вычитают из полученного значения OD590 образцов, обработанных протеазой; определяют термостабильность протеазы посредством расчета процентной активности протеазы в образцах, преинкубированных при 70°С, относительно активности протеазы в образцах, инкубированных во льду, как 100%-ной активности.
Изобретение относится к области клеточной биологии, клеточной трансплантологии и тканевой инженерии. Способ повышения ангиогенной активности стромальных клеток жировой ткани в тканях и органах включает выделение стромальных клеток жировой ткани, культивирование выделенных клеток в присутствии фактора некроза опухолей-альфа в количествах 5 или 100 нг/мл в течение 24-72 часов с последующим трансплантированием в ткани или органы.
Изобретение относится к области биотехнологии, клеточным технологиям и тканевой хирургии. Способ получения культуры гладкомышечных клеток заключается в том, что вырезают фрагмент кровеносного сосуда, измельчают его на кусочки до размеров не более 2 мм в любом измерении и инкубируют кусочки в культуральном флаконе с предварительно нанесенными на дно флакона царапинами, содержащем среду для культивирования, содержащую 10% эмбриональной фетальной сыворотки, в течение по меньшей мере 10 дней, но не более 24 дней, при температуре 37°С в условиях СО2-инкубатора, отличающийся тем, что упомянутым фрагментом кровеносного сосуда является фрагмент восходящего отдела грудной аорты, вырезаемый в ходе процедуры аортокоронарного шунтирования, а упомянутые кусочки фрагмента восходящего отдела грудной аорты перед инкубированием выдерживают в среде для культивирования, содержащей 0,1% коллагеназы, в течение по меньшей мере 30 минут, но не более 60 минут, при температуре 37°С, после чего промывают средой для культивирования клеток.
Способ получения мезенхимальных стволовых клеток из плюрипотентных стволовых клеток человека и мезенхимальные стволовые клетки, полученные этим способом // 2528250
Изобретение относится к области генетической инженерии, тканевых технологий и медицины. Способ получения мезенхимальных стволовых клеток из плюрипотентных линий стволовых клеток человека включает получение эмбриоидных телец из плюрипотентных стволовых клеток человека, прикрепление эмбриоидных телец к чашке Петри для индукции спонтанной дифференцировки эмбриоидных телец в мезенхимальные стволовые клетки, культивирование с пролиферацией мезенхимальных стволовых клеток при сохранении идентичности мезенхимальных стволовых клеток, и где индукция спонтанной дифференцировки стадии происходит путем формирования петель аутологичного цитокина без добавления внешнего цитокина, также соответствующие клетки, их применение, набор и способ культивирования.
Изобретение относится к области молекулярной биологии, биохимии и медицины. Предложена композиция для индукции миграции стволовых клеток жировой ткани взрослых, которая содержит в качестве активного ингредиента человеческие мезенхимальные стволовые клетки из жировой ткани взрослых в количестве от 1х107 до 1х1010, которые экспрессируют на клеточной поверхности рецептор хемокина или фактора роста, или секреторный продукт из этих стволовых клеток включает рецептор хемокина или фактора роста; где секретируемый продукт стволовых клеток жировой ткани взрослых представляет собой адипонектин; и где человеческие стволовые клетки жировой ткани взрослых подвергаются первичному воздействию смесью, содержащей хемокин или фактор роста.
Изобретение относится к биотехнологии и медицине. Предложен способ экспансии мононуклеарных клеток пуповинной крови (пкМНК) ex vivo в присутствии мультипатентных мезенхимальных клеток (ММСК), включающий культивирование ММСК из стромально-васкулярной фракции жировой ткани до достижения монослоя при концентрации O2 в среде 5%, добавление суспензии пкМНК к монослою ММСК, культивирование в течение 72 часов при концентрации O2 в среде 5%, отбор неприкрепленных пкМНК и замену среды, продолжение культивирования ММСК с прикрепившимися к ним пкМНК в течение 7 дней при концентрации O2 в среде 5%.
Изобретение относится к области биотехнологии и медицины. Предложена композиция, содержащая стволовые клетки из амниотической жидкости человека с фенотипом CD73+/CD90+/CD105+/CK19+, питательную среду, эритропоэтин, эпидермальный фактор роста и коллаген, взятые в эффективном количестве.
Изобретение относится к области медицины и клеточных технологий. Предложен клеточный продукт, содержащий популяцию протоковых стволовых клеток подчелюстной слюнной железы, характеризующихся фенотипом CD49f+/EpCAM+ и после обработки вальпроевой кислотой в концентрации 0,1-40 мМ и культивирования в коллагеновом геле меняющих профиль экспрессии на 1AAT+/PEPCK+/G6P+/TDO+/CYP Р4503А13+, а также приобретающих способность синтезировать мочевину и альбумин.
Изобретение относится к области биотехнологии, клеточной и тканевой инженерии. Описан способ получения резидентных стволовых клеток сердца млекопитающего, экспрессирующих поверхностные маркеры c-kit, и/или sca-1, и/или MDR1, в ходе которого выделяют образцы ткани миокарда, измельчают их, обрабатывают коллагеназой и трипсином, проводят культивирование на культуральной чашке с покрытием из фибронектина методом эксплантной культуры измельченных образцов с последующей иммуноселекцией.
Изобретение относится к области биохимии, биотехнологии и медицины. Предложен N-концевой фрагмент растворимого супрессора иммунного ответа длиной в 21 аминокислоту, имеющий последовательность аминокислот по Seq ID NО: 1, позволяющий стимулировать образование регуляторных Т-лимфоцитов, а также способ стимуляции образования регуляторных Т-лимфоцитов N-концевым фрагментом растворимого супрессора иммунного ответа с Seq ID NО: 1, при введении его в концентрации 0,1-50 мкг/мл.
Изобретение относится к фармацевтической промышленности и представляет собой дерматологический крем, предназначенный для местного лечения бактериальных инфекций кожи и для заживления связанных с ними ран, содержащий фрамицетина сульфат и биополимер, включенные в кремовую основу, которая содержит по крайней мере одно вещество из каждой следующей группы: консервант; первичный и вторичный эмульгатор, выбранные из группы, содержащей кетостеариловый спирт, кетомакрогол 1000, полисорбат-80 и Span-80; парафин в качестве воскообразного продукта; совместный растворитель, выбранный из группы, включающей пропиленгликоль, гексиленгликоль и полиэтиленгликоль-400; азотную кислоту или молочную кислоту и воду, а указанный биополимер предпочтительно является хитозаном.
Изобретение относится к области биотехнологии, конкретно к клеточным технологиям, и может быть использовано в медицине. Способ включает масштабирование диплоидных клеток линии М-20 из криобанка ИПВЭ им. М.П. Чумакова РАМН из ампулы банка посевных клеток 7 пассажа с получением банка рабочих клеток 16 пассажа. При этом клетки 20-33 пассажей, пригодные для использования в лечебных иили диагностических целях, получают путем культивирования в питательной среде, содержащей 10 фибринолитически активной плазмы человека, содержащей тромбоцитарный фактор роста PDGF в концентрации от 155 до 342 пгмл. Изобретение позволяет повысить пролиферативную активность диплоидных клеток фибробластов человека. 1 з.п. ф-лы, 2 табл.
Кожа человека по своему строению невероятно сложна и проста одновременно. Каждое звено в цепочке имеет свое место, каждая клеточка выполняет возложенную на нее функцию. Межклеточное пространство занимает соединительная ткань. Именно она питает клетки и поддерживает их. Строение соединительной ткани - целая наука. Она включает в себя важные элементы, к которым относятся и фибробласты.
Фибробласты - это новое направление в клеточной терапии. На их основе разрабатываются клеточные технологии. Уровень экспрессии в тканях зависит от расположения фибробластов.
Что это такое
Фибробласт является самой ценной клеткой соединительной ткани, им принадлежит ключевая роль. Название его образовано двумя словами: fibra - волокно, blastos - росток. Образуются фибробласты из стволовых клеток, которые имеют овальную или круглую форму с отростками. Фибробласты формируют соединительную ткань, ее каркас, регулируют клеточное взаимодействие.
Основная роль фибробластов - метаболизм межклеточного вещества. Механизм воздействия фибробластов наделен огромной мощностью, которую используют в клеточной терапии. Фибробласты продуцируют проколлаген, проэластин, фибронектин и пр. В совокупности эти элементы позволяют полностью регулировать клеточную деятельность в тканях. Фибробласты стимулируют фактор роста соединительной ткани, которая стимулирует и образование новых фибробластов.
В совокупности это представляет систему, в которой создается множество положительных обратных связей.
Многочисленные попытки культивировать фибробласты in vitro (в пробирке) были увенчаны положительным результатом. Культивированные фибробласты сохраняют все основные свойства первичной культуры.
Состав
Получают фибробласты из двумя способами: с помощью ферментативной обработки и механическим способом. После получения первичной культуры ее промывают физиологическим раствором (содержащим антибиотик) и обрабатывают раствором специального фермента коллагеназы (или трипсина). Далее действуют по алгоритму:
- Освобождают от матрикса,
- Осаждают с помощью центрифугирования,
- Отмывают от ферментов,
- Культивируют в СО 2 -инкубаторе.
В результате получают гетерогенную популяцию, в которой находятся фибробласты на разных стадиях своего развития: делящиеся, созревающие, зрелые и т. д. Фибробласты делятся на два вида, которые имеют разную скорость деления и роста. На свойства фибробластов влияют несколько факторов:
- Способ культивирования,
- Количество пассажей,
- Тип сыворотки,
- Тип среды,
- Область, из которой производился забор первичной культуры,
- Возраст донора.
Сравнение с другими материалами этого типа
Сегодня существует огромное количество и . Это могут быть аналоги естественных компонентов матрикса или биосовместимые материалы, которые близки по своим свойствам с тканями организма. Ко всем этим веществам предъявляются очень строгие требования, которым они должны отвечать:
- Безопасность,
- Стабильность,
- Эффективность,
- Рентабельность,
- Вещество не должно вызывать аллергию,
- Физиологичность,
- Удобство в применении.
Добиться полного совершенства материала невероятно сложно, ни один из наполнителей не обладает всеми качествами одновременно. Каждый выбор продиктован поставленной задачей. Все материалы подразделяют на несколько групп:
- Гидрофобные препараты , производные полидиметилсилоксана: Silikon-1000, Adatosil-5000, Biopolimero-350 (Испания)., Bioplastique (Голландия)., SilSkin. Это - силиконовые препараты, которые не подвергаются биодеградации и не вызывают аллергической реакции. Возможно осложнение - неспецифическое воспаление.
- Гидрофильные препараты . Самым распространенным в этой группе является полиакриламидный гель, который выпускается разными производителями: Амазингель (Китай), (Голландия), Дермалайф (Франция), Агриформ, Формакрил, Биоформакрил, Космогель (Россия), Интерфалл (Украина). Материалы так же не подвергаются биодеградации.
- Гиалуроновая кислота и Декстран . Препараты: Ривидерм интра (Голландия), Матридур, Матридекс (Германия). Эти препараты предназначены , овала лица, для . Препараты стимулируют синтез коллагена и наделены длительным эффектом.
- Препараты на основе бычьего коллагена . Resoplast (Голландия), Zyplast, GeteroCollagen (США), Fibrel, PlasmaGel, Cosmoplast, DermiCol, Dennalogen, Fascian, Alloderm, Allo Collagen (США) и др. Эти препараты занимают лидирующее место и используются в мировой практике более 100 лет. Эффект сохраняется до года. Но препараты этой группы могут вызвать аллергию.
- Препараты на основе . (Швеция), Hylafoorm fine line, MacDermol, Hylaform plus, (Франция), Restylane fine line, Macrolane, Hylaform (Канада), Rofilan hyan (Голландия). Эти препараты эффективны при коррекции морщин и . Недостаток - кратковременность эффекта.
В отличии от этих препаратов использование живой клетки дает максимально длительный эффект и сводит к минимуму риск побочных эффектов.

Популярные производители и продукты
Назовем популярных производителей, коммерческие продукты которых официально применяются в медицинской практике:
- Advanced Biohealing, США. Продукт - Dermagraf,
- Forticell Bioscience, Inc, США. Продукт - OrCel,
- Genzyme Corporation, США. Продукт - Epicel,
- Intercytex, Великобритания. Продукты - Cizact (ICX-PRO), Vavelta, ICX-TRC,
- Invitrx, Inc, США. Продукт - Invitrx CSS.
Использование в косметологии и пластической хирургии
В косметологии и пластической хирургии используют два вида фибробластов: аллогенные (чужеродные) и аутологичные фибробласты (те, которые берутся у самого реципиента). Фибробласты эффективно используют в процедурах омоложения. Их действие значительно отличается от действия аналогов, поскольку они устраняют не последствия (старения, патологии и пр.), а саму причину явления.
Показания для их применения - это солидный список:
- Профилактика старения, морщины, растяжки,
- Снижение упругости и эластичности,
- Сухость кожи,
- Улучшение цвет лица,
- Птоз, коррекция лица,
- Нехирургическая коррекция возрастных изменений (лицо, шея, зона декольте, тыльная сторона рук),
- Нарушение структуры кожи после акне,
- Коррекция атрофических рубцов,
- Коррекция дефектов носа и мягких тканей лица,
- Раны, ожоги,
- Терапия дерматологических заболеваний,
- Длительно незаживающие раны.
Хороший эффект дает сочетание разных методик.
Противопоказания
- Заболевания иммунной системы,
- Инфекционные и вирусные заболевания,
- Онкология,
- Беременность и период лактации,
- Пониженная свертываемость крови,
- Обострение хронических заболеваний кожи,
- Склонность к образованию рубцов.

Техника использования
Для введения используют собственные фибробласты (аутологичные) и аллогенные (чужеродные). В первом случае требуется подготовка культуры, которая проводится за несколько недель до самой процедуры введения. Во втором случае используют готовую культуру, которая хранится в донорском банке. Эту процедуру можно делать в любое назначенное время. Алгоритм проведения процедуры:
- Диагностика кожи,
- Сбор анамнеза для выявления противопоказаний,
- Введение фибробласта,
- Нанесение специального крема, который гарантирует высокий уровень защиты от солнечных лучей.
Продукт вводят с помощью специальных тонких игл, используя одну из двух техник: туннельную или папульную. Анестетик применяют в тех случаях, когда снижен болевой порог. Обычно проводят несколько сеансов (от 2 до 6) с интервалом в 3 недели.
Про фибробласты расскажет это видео: