Приобретенная парциальная красноклеточная аплазия: причины, симптомы, лечение, признаки, прогноз. Проявление апластической анемии крови – аплазия костного мозга Красноклеточная аплазия костного мозга
Читайте также
Артемьева Вероника из Нижнего Тагила спрашивает:
Что такое гипоплазия костного мозга, и какими симптомами сопровождается это заболевание?
Ответ эксперта:
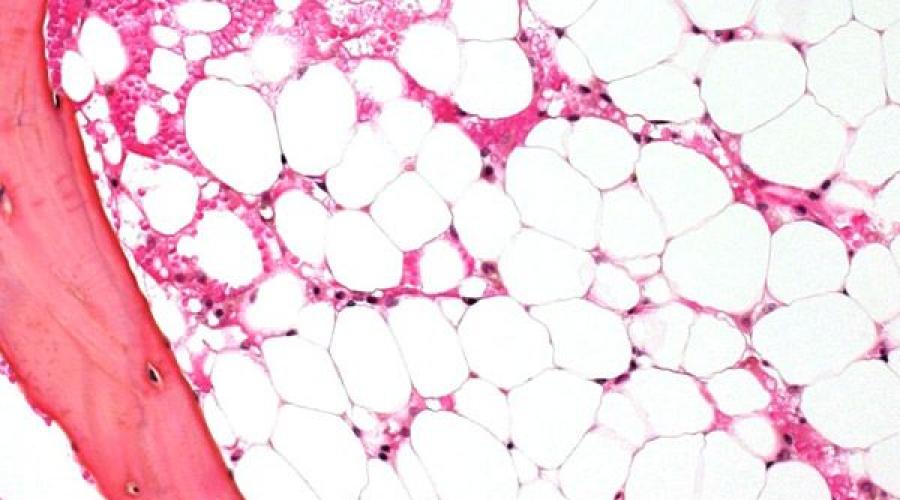
Гипоплазия костного мозга – это состояние, при котором миелоидная ткань замещается жировой. Само понятие «гипоплазия» в переводе означает недостаточность формирования. При недостаточном формировании миелоидной ткани нарушается функция красного костного мозга, в результате чего значительно снижается выработка кровяных клеток – лейкоцитов, эритроцитов, тромбоцитов. Недостаточность костного мозга является одной из разновидностей панцитопении.
Причины развития
Существует две формы болезни:
- наследственная;
- приобретенная.
Причиной развития наследственных форм являются следующие патологии:
- анемия Фанкони;
- врожденный дискератоз;
- анемия Даймонда-Блекфена;
- другие генетические заболевания.
Недостаточность выработки кровяных клеток может выступать в качестве самостоятельного заболевания при апластической анемии или развиваться на фоне следующих заболеваний:
- цирроза печени;
- хронического гепатита;
- злокачественных новообразований;
- различных аутоиммунных расстройств.
Проявления болезни
В организме больных людей объем крови гораздо ниже, чем у здоровых. В результате снижения количества тромбоцитов, у пациентов возникают спонтанные кровотечения. Опасность могут представлять любые порезы, травмы, приводящие к значительной потере крови. Кровоточивости подвержены слизистые оболочки и внутренние органы.
Недостаточность выработки лейкоцитов приводит к снижению иммунитета, способствующего возникновению частых инфекционных заболеваний.
Принципы лечения
Лечением данной патологии занимается врач-гематолог. Выбор способа терапии зависит от причины возникновения болезни. Апластическую анемию возможно устранить только путем пересадки костного мозга. Если не удается найти подходящего донора, больному показан прием препаратов, угнетающих иммунную систему (Циклоспорина А). Иммунодепрессивная терапия позволяет добиться успеха только при нетяжелых формах болезни.
Всем без исключения пациентам производят внутривенное введение тромбоцитарной и эритроцитарной массы. В целях предотвращения развития инфекционных и грибковых поражений больным назначается прием антибактериальных и противогрибковых препаратов.
Одной из причин недостаточного содержания кровяных клеток является повышение активности селезенки – гиперспленизм. Поэтому пациентам может быть проведена спленэктомия – операция, в ходе которой производят удаление селезенки.
Видео: Что такое трансплантация костного мозга
Апластическая анемия - тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия - достаточно редкое заболевание. Средняя заболеваемость - 3-5 на 1 млн. всего населения за год. Большинство больных - дети и молодые люди.
Виды апластических анемий
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
Апластическая анемия у детей
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Причины и факторы риска возникновения апластических анемий
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза - механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри - физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом - выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Что происходит при апластической анемии
Красный костный мозг - основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О 2 и СО 2 ), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, - резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов - причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда - аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга - прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов - как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Как заподозрить апластическую анемию - симптомы и признаки болезни
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Низкая работоспособность;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Бледность кожи;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Диагностика апластической анемии
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Дефицит тромбоцитов;
· Низкое количество ретикулоцитов - незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) - ниже 30%, могут отсутствовать мегакариоциты - клетки-предшественники тромбоцитов.
Степени тяжести апластической анемии
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность - ниже 25%; в периферической крови: нейтрофилов - < 0,5х10 9 /л, тромбоцитов - < 20х10 9 /л, ретикулоцитов - < 20х10 9 /л.
Крайне тяжелая форма болезни: клеточность - ниже 25; в периферической крови: нейтрофилов - < 0,2х10 9 /л, тромбоцитов - < 20х10 9 /л, ретикулоцитов - < 20х10 9 /л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Лечение апластической анемии
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале - близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии - антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ - это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А - селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение - это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Правильный образ жизни при апластической анемии
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности - избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Осложнения апластической анемии
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
Прогноз при апластической анемии
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз - 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет - 75%).
Профилактика апластической анемии
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
Парциальная красноклеточная аплазия (ПККА) - это синдром с резким подавлением продукции эритроцитов, изолированной нормохромной анемией и глубокой ретикулоцитопе- нией.
Впервые ПККА описал в 1922 г. Kaznelson. В дальнейшем был описан ряд случаев этого заболевания, при этом у значительной части больных выявлена опухоль вилочковой железы (тимома).
В последующем появились описания врожденной формы ПККА, которая проявлялась в первые 2 года жизни. В настоящее время описано не более 300 больных ПККА и показано, что это не одно, а несколько различных заболеваний. В одних случаях даже при длительном наблюдении за больным не удается выявить связи ПККА с какими-либо другими болезнями (идиопатическая форма ПККА). В других случаях ПККА связана с опухолью вилочковой железы; нередко этот синдром становится первым проявлением какого-либо гемобластоза. Некоторые авторы выделяют особую (подростковую) форму ПККА с благоприятным течением.
Клинические признаки
Болезнь начинается постепенно. Жалобы, предъявляемые больными: на недомогание, на резкую слабость, быструю утомляемость, боли в области сердца.
При объективном осмотре таких больных наблюдается бледность кожных покровов, а также видимых слизистых оболочек, при этом отсутствует их желтушность. Как правило, температура тела в пределах нормы. В связи с гемосидерозом достаточно часто увеличивается печень. Селезенка увеличена редко.
Картина крови
У большинства больных ПККА выявляется выраженная нор- мохромная анемия с малым количеством ретикулоцитов; число лейкоцитов чаще нормальное или даже увеличенное, однако у ряда больных выявляется умеренная лейкопения, иногда - нейтрофильный сдвиг влево. Количество тромбоцитов чаще нормальное, гораздо реже слегка сниженное. СОЭ значительно увеличена.
В костном мозге чаще выявляются угнетение эритроидного ростка при нормальном содержании мегакариоцитов и грану- лоцитов, иногда фагоцитоз эритрокариоцитов макрофагами. В костном мозге соотношение между кроветворной частью и жиром нормальное; характерны структурные изменения.
Течение хроническое, в некоторых случаях получается достичь ремиссии, однако у большинства терапевтические мероприятия не приводят к полной нормализации гематологических показателей. У ряда больных на фоне ПККА начинают постепенно проявляться признаки гемобластоза. Выявляются палочкоядерный сдвиг или напоминающий пельгеровскую аномалию, появляются базофилия, эозинофилия, иногда мо- ноцитоз. Цитогенетическое исследование на начальных этапах болезни не выявляет изменений. В редких случаях по мере прогрессирования процесса может выявиться клон опухолевых (лейкозных) клеток. Иногда постепенно выявляются признаки своеобразного миелопролиферативного заболевания без Ph" - хромосомы. В некоторых случаях развиваются эритромиелоз, острый недифференцируемый лейкоз, при котором на поверхности бластов можно обнаружить эритробластный антиген. У части больных ПККА выявляется М-градиент, в состав которого чаще всего входит IgG.
Подростковая форма ПККА. Существует особая форма заболевания, выявляемая в возрасте от 12 до 22 лет. Эта форма начинается также постепенно, но развивается быстрее, чем у взрослых. У некоторых больных удается прощупывать селезенку. Морфологические изменения такие же, как при ПККА у взрослых: выраженная анемия при отсутствии ретикулоци- тов и нормальном количестве нейтрофилов и тромбоцитов, отсутствие или резкое снижение содержания эритрокариоци- тов в костном мозге.
В отличие от антител, характерных для аутоиммунной гемолитической анемии с неполными тепловыми агглютининами, антитела, снятые с поверхности эритроцитов больных ПККА, фиксируются ко всем донорским эритроцитам, кроме обработанных папаином. Антитела с эритроцитов больных аутоиммунной гемолитической анемией с неполными тепловыми агглютининами фиксируются как на неизмененных донорских эритроцитах, так и на обработанных папаином. Значение этих антител в механизме развития ПККА неясно, но они выявляются как у взрослых людей, страдающих ПККА, так и при подростковой и врожденной формах ПККА.
У значительной части больных ПККА в сыворотке выявляется М-градиент, т. е. имеются моноклональные антитела.
Механизм развития подростковой формы до конца не ясен. Много работ посвящено изучению врожденной формы Дайе- монда-Блекфана. Известно, что эта болезнь наследственная. У некоторых детей с редукцией красного ростка был найден ингибитор, относящийся к классу IgG, но у них была другая форма болезни - так называемая транзиторная эритробластопения, дающая спонтанные ремиссии. Имеются данные о том, что при синдроме Дайемонда-Блекфана есть иммунные лимфоциты, нарушающие эритроидное кроветворение, но строгих доказательств не получено.
Синдром Дайемонда-Блекфана. Болезнь обычно начинается у детей, не достигших 4 месяцев; обращают внимание на резкую бледность ребенка. Иногда при случайном анализе крови выявляют выраженную анемию. Заболевание поражает одинаково часто детей обоего пола.
Как и при анемии Фанкони, при синдроме Дайемонда- Блекфана иногда наблюдаются изменения в больших пальцах рук. Кроме того, некоторые больные имеют короткую шею, как при синдроме Шерешевского-Тернера. Увеличение печени и селезенки нехарактерно, за исключением больных, получивших многочисленные гемотрансфузии. В этих случаях ге- патомегалия и увеличение селезенки связаны с гемосидерозом органов. Частый симптом - задержка роста.
В анализах крови - выраженная анемия, ретикулоцитопе- ния, угнетение красного ростка костного мозга при нормальном количестве нейтрофилов и тромбоцитов.
Увеличено содержание фетального гемоглобина. Дайемонд с соавторами обнаружили, что уровень фетального гемоглобина у 9 из 12 шестимесячных детей колеблется от 5 до 25%, тогда как у детей контрольной группы его содержание не превышало 5%.
Выявить антитела к эритробластному антигену в сыворотке у детей не удается. На поверхности эритроцитов при помощи агрегат-гемагглютинационной пробы обнаруживаются антитела, чаще класса IgА, реже - IgG.
Диагностика
О ПККА у взрослых людей следует думать тогда, когда при выраженной анемии отсутствуют или резко снижены ретику- лоциты, а уровень тромбоцитов и нейтрофилов нормальный или почти нормальный. В костном мозге чаще отсутствуют или почти отсутствуют эритрокариоциты при нормальном количестве нейтрофилов и мегакариоцитов, нет увеличения количества бластов. Следует отметить, что редукция красного ростка развивается не только при ПККА. Достаточно частым явлением служит ее развитие при обычной форме аутоиммунной гемолитической анемии с неполными тепловыми агглютининами в период тяжелого обострения. Так как антител становится много, они уничтожают не только периферические эритроциты, против антигена которых они направлены, но и эритрока- риоциты, на поверхности которых также имеется этот антиген, но в значительно меньшем количестве. При таких формах в отличие от ПККА повышена температура. Помогает исследование специфичности антител.
После выявления ПККА следует исключить опухоль ви- лочковой железы, для этого рентгенологически тщательно исследуют переднее средостение, а при подозрении на тимому делают пневмомедиастинограмму.
У детей при синдроме Дайемонда-Блекфана бывают те же изменения крови. Дети легко реагируют на лечение глюкокортикостероидами, поэтому возможны диагностические ошибки, если впервые исследуют содержание ретикулоцитов и производят стернальную пункцию после назначения преднизолона.
В этих случаях обнаруживают раздражение красного ростка костного мозга, а не его угнетение и повышенное содержание ретикулоцитов, а не пониженное. Необходимо исследовать костный мозг и содержание ретикулоцитов до назначения преднизо- лона или через некоторое время после его отмены.
Лечение ПККА требует длительного времени и не всегда эффективно, но обеспечивает улучшение более чем у половины больных. Если ПККА - следствие опухоли вилочковой железы, то необходимо удаление вилочковой железы, хотя операция без дополнительного лечения не всегда приводит к улучшению состояния. Большие дозы преднизолона эффективны при подростковой форме ПККА, при синдроме Дайемонда-Блекфана и редко улучшают состояние взрослых. Чаще преднизолон если и эффективен, то временно. У подростков хорошие результаты дает удаление селезенки, что само по себе может привести к улучшению, у взрослых так бывает крайне редко. Во время удаления селезенки врач назначает преднизолон для профилактики снижения в крови кортикостероидов, так как больные долго принимают его до операции. В качестве профилактики тромбоза используют гепарин, вводимый в кожу живота по 5000 ЕД 2-3 раза в день. В дальнейшем с той же целью гепарин заменяют курантилом.
В тех случаях, когда удаление селезенки не приносит результатов, используют цитостатики. Вначале лечат одним препаратом; заранее указать наиболее эффективный препарат невозможно. Для профилактики гемосидероза используют десферал. В некоторых случаях полезны повторные плазмаферезы.
У больных с опухолью вилочковой железы после удаления опухоли назначают один из цитостатических препаратов.
Аплазия костного мозга (или аплазия кроветворения) – это синдромы недостаточности костного мозга, которые включают группу расстройств, при которых резко подавляется функция кроветворения, которую выполняет костный мозг. Следствием данного нарушения является развитие панцитопении (наблюдается дефицит всех кровяных клеток: лейкоцитов, эритроцитов, а также тромбоцитов). Глубокая панцитопения является опасным для жизни состоянием.
, , , , ,
Код по МКБ-10
D60-D64 Апластические и другие анемии
Эпидемиология
Факторы риска
Среди факторов риска аплазии костного мозга выделяются описанные ниже.
- химические соединения: цитостатики – они способствуют прекращению деления клеток, их обычно используют для терапии опухолей. Определённая дозировка таких препаратов может повредить костный мозг, нарушив образование кровяных клеток; иммунодепрессанты – подавляют иммунную систему организма, их используют, когда наблюдается избыточная активация иммунитета, при которой повреждаются собственные здоровые ткани. Если отменить их приём, кроветворение зачастую восстанавливается;
- вещества, которые воздействуют на организм, если у больного имеется к ним индивидуальная гиперчувствительность. Это антибиотики (антибактериальные лекарства), бензин, ртуть, различные красители, хлорамфеникол, а также препараты золота. Такие вещества способны вызвать и обратимое, и необратимое разрушение функции костного мозга. Они могут попасть в организм через кожный покров, при дыхании аэрозольным способом, перорально - вместе с водой и едой;
- облучение ионными частицами (радиация) – к примеру, если нарушены правила техники безопасности на АЭС или в медучреждениях, где проводится лечение опухолей при помощи лучевой терапии;
- вирусные инфекции – такие, как грипп, вирус гепатита и пр.
, , , , , , , , ,
Патогенез
Патогенез аплазии костного мозга пока не изучен полностью. В наши дни рассматривается несколько различных механизмов его развития:
- Костный мозг поражается через полипотентную стволовую клетку;
- Кроветворный процесс подавляется из-за воздействия на него гуморальных или клеточных иммунных механизмов;
- Компоненты микроокружения начинают функционировать неправильно;
- Развитие дефицита факторов, которые способствуют кроветворному процессу.
- Мутации в генах, вызывающие наследственные синдромы недостаточности костного мозга.
При данном заболевании содержание компонентов (это витамин B12, железо, а также протопорфирин), которые непосредственно участвуют кроветворении, не уменьшается, но в то же время кроветворная ткань не может их использовать.
Симптомы аплазии костного мозга
Аплазия костного мозга проявляется в зависимости от того, какой клеточный элемент крови был поражён:
- Если наблюдается понижение уровня эритроцитов, появляется одышка и общая слабость и другие симптомы анемии;
- Если понижается уровень лейкоцитов, возникает лихорадка и повышается восприимчивость организма к инфекциям;
- Если снижен уровень тромбоцитов, появляется склонность к развитию геморрагического синдрома, возникновению петехий, а также к кровотечениям.
При парциальной красноклеточной аплазии костного мозга наблюдаются резкое снижение выработки эритроцитов, глубокая ретикулоцитопения, а также изолированная нормохромная анемия.
Существует врождённая и приобретённая формы данного заболевания. Вторая проявляется под видом приобретённого первичного эритробластофтиза, а также синдрома, возникающего при иных заболеваниях (это может быть рак лёгких, гепатит, лейкоз, инфекционный мононуклеоз или пневмония, а также серповидноклеточная анемия, паротит или язвенный колит и пр.).
Осложнения и последствия
Среди осложнений аплазии костного мозга:
- Анемическая кома, при которой происходит потеря сознания, развитие коматозного состояния. Отсутствует реакция на любые внешние раздражители, так как кислород не поступает в головной мозг в нужных количествах – это происходит из-за того, что уровень эритроцитов в крови быстро и значительно уменьшается;
- Начинаются разнообразные кровотечения (геморрагические осложнения). Наихудшим вариантом в этом случае является геморрагический инсульт (некоторая часть головного мозга пропитывается кровью и вследствие этого погибает);
- Инфекции – микроорганизмы (разнообразные грибки, бактерии или вирусы) становятся причиной возникновения инфекционных болезней;
- Нарушение функционального состояния некоторых внутренних органов (таких, как почки или сердце), особенно при сопуствующей хронической патологии.
Диагностика аплазии костного мозга
При диагностике аплазии костного мозга проводится изучение анамнеза болезни, а также жалоб пациента: насколько давно появились симптомы заболевания, и с чем больной связывает их появление.
- Наличие у пациента сопутствующих хронических болезней.
- Наличие наследственных болезней.
- Есть ли у больного вредные привычки.
- Уточняется, проводился ли недавно длительный приём каких-либо лекарств.
- Наличие у пациента опухолей.
- Был ли контакт с различными токсическими элементами.
- Оказывалось ли на больного воздействие лучевого облучения или иных радиационных факторов.
После этого проводится физикальный осмотр. Определяется цвет кожи (при аплазии костного мозга наблюдается бледность), определяется частота пульса (чаще всего он учащён) и показатели АД (оно пониженное). Обследуются слизистые оболочки и кожные покровы на предмет наличия кровоизлияний и гнойных пузырьков и пр.
Анализы
В процессе диагностики заболевания проводятся и некоторые лабораторные исследования.
Выполняется анализ крови – если у пациента аплазия костного мозга, будет выявлено понижение уровня гемоглобина, а также количества эритроцитов. Цветовой показатель кровипри этом остаётся в норме. Уменьшается число тромбоцитов с лейкоцитами, а помимо этого нарушается правильное соотношение лейкоцитов, потому как уменьшается содержание гранулоцитов.
Проводится также анализ мочи, чтобы определить наличие эритроцитов в моче – это является признаком геморрагического синдрома, либо наличие лейкоцитов и микроорганизмов, что является симптомом развития в организме инфекционных осложнений.
Проводится также и биохимический анализ крови. Благодаря нему выясняются показатели глюкозы, холестерина, мочевой кислоты (чтобы выявить сопутствующее поражение каких-либо органов), креатинина, а также электролитов (натрия, калия и кальция).
, , , , , , , ,
Инструментальная диагностика
При инструментальной диагностике проводятся следующие процедуры.
С целью обследования костного мозга выполняется пункция (прокалывание, при котором извлекается внутреннее содержимое) какой-либо кости, обычно таковой является грудина или тазобедренная кость. С помощью микроскопического обследования определяется замещения кроветворной ткани на рубцовую либо жировую.
Трепанобиопсия, при которой обследуется костный мозг, а также его соотношение с находящимися рядом тканями. Во время данной процедуры используется специальный аппарат, который называется трепан – с его помощью из подвздошной кости берётся столбик костного мозга вместе с надкостницей, а также костью.

Электрокардиография, которая позволяет выявить проблемы с питанием сердечной мышцы, сердечным ритмом.
Лечение аплазии костного мозга
Устранить болезнь при помощи этиотропного лечения (воздействовав на его причину) почти невозможно. Может помочь устранение провоцирующего фактора (например, отмена принимаемого лекарственного препарата, выезд из зоны радиации и пр.), но в этом случае лишь снижается скорость гибели костного мозга, а вот стабильное кроветворение этим способом восстановить не удаётся.
Иммуносупрессивное лечение проводится, если нельзя провести трансплантацию (нет подходящего больному донора). В этом случае используются лекарства из групп циклоспорина А либо антилимфоцитарного глобулина. Иногда их применяют совместно.
Применение ГМ-КСФ (лекарства, которые стимулируют выработку лейкоцитов). Это лечение используют, если количество лейкоцитов падает до уровня менее 2х109 г/л. Также в этом случае могут применяться кортикостероидные лекарственные средства.
Применяются анаболические стероиды, которые стимулируют образование белка.
В процессе лечения аплазии костного мозга применяются такие методы:
- Переливание элементов крови.
Выполняется переливание отмытыми эритроцитами (это донорские эритроциты, которые освобождают от белков) – этот метод уменьшает выраженность и количество негативных реакций на процедуру переливания. Делают такое переливание только, если существует угроза жизни больного. Таковыми являются следующие состояния:
- пациент впадает в анемическую кому;
- анемия тяжёлой степени тяжести (в этом случае показатель уровня гемоглобина падает ниже отметки 70 г/л).
Переливание донорских тромбоцитов осуществляют, если у пациента наблюдаются кровотечения и явно выраженное уменьшение числа тромбоцитов.
Кровоостанавливающую терапию проводят в зависимости от области, в которой началось кровотечение.
При возникновении инфекционных осложнений проводятся таки методы терапии:
- антибактериальное лечение. Его выполняют после того, как взяты мазки из носоглотки, а также моча и кровь на посев, чтобы определить, какой микроорганизм стал причиной возникновения инфекции, а также выявить его чувствительность к антибиотикам;
- обязательно выполняется системное противогрибковое лечение;
- местная обработка антисептиком участков, которые могут стать входными воротами инфекции (это те места, через которые бактерии, грибки или вирусы попадают в организм). Под такими процедурами обычно подразумевают полоскание рта с использованием по очереди разных лекарств.
Лекарства
При аплазии костного мозга обязательно используется медикаментозное лечение. Чаще всего применяют препараты, относящиеся к 3 лекарственным группам: это цитостатики (6-меркаптопурил, циклофосфан, метотрексат, циклоспорин А, а также имуран), иммунодепрессанты (дексаметазон, а также метилпреднизолон) и антибиотики (макролиды, цефалоспорины, хлорхинолоны, а также азалиды). Иногда могут применяться лекарства, корректирующие нарушения кишечной микрофлоры и проблемы с АД, ферментные лекарства и пр.
Метилпреднизолон прописывают внутрь. При пересадке органов – в дозировке не более 0,007 г/сут.
Побочные эффекты лекарственного препарата: вода, а также натрий могут задерживаться в организме, повышается АД, может наблюдаться потеря калия, остеопороз, мышечная слабость, лекарственный гастрит; может снижаться сопротивляемость разным инфекциям; подавление деятельности надпочечников, некоторые психические расстройства, проблемы с менструальным циклом.
Лекарство противопоказано при тяжёлой стадии гипертонической болезни; при 3 стадии недостаточности кровообращения, а кроме этого при беременности и остром эндокардите, а также нефритах, различных психозах, остеопорозе, язвах 12перстной кишки или желудка; после недавней операции; при активной стадии туберкулёза, сифилисе; людям пожилого возраста, а также детям младше 12 лет.
Метилпреднизолон с осторожностью назначают при наличии сахарного диабета, только если имеются абсолютные показания либо для лечения у пациентов с резистентностью к инсулину, с высокими титрами антиинсулиновых антител. При туберкулёзе или инфекционных болезнях использовать лекарство можно, лишь комбинируя его с антибиотиками либо препаратами, лечащими туберкулёз.
Имуран – в первый день разрешено применять дозу не более 5 мг на 1 кг веса человека в сутки (необходимо употребить в 2-3 приёма), но дозировка в целом зависит от режима иммуносупрессии. Размер поддерживающей дозы – 1-4 мг/кг веса в сутки. Её устанавливают в зависимости от толерантности организма пациента и его клинического состояния. Исследования указывают, что лечение с применением Имурана нужно проводить длительным курсом, даже применяя маленькие дозы.
При передозировке могут появиться язвы в горле, кровотечения и синяки, а также инфекции. Такие признаки более характерны при хронической передозировке.
Побочные эффекты – после пересадки костного мозга при лечении азатиоприном в сочетании с другими иммуносупрессорами у пациентов часто наблюдаются бактериальные, грибковые или вирусные инфекции. Среди прочих побочных реакций – аритмия, признаки менингизма, головные боли, поражение губ и ротовой полости, парестезии и пр.
Циклоспорин А применяют внутривенно – суточная доза разделяется на 2 приёма и вводится за 2-6 ч. Для начальной суточной дозы достаточно 3-5 мг/кг. Внутривенное применение является оптимальным в процессе лечения пациентов, которым была совершена трансплантация костного мозга. Перед пересадкой (4-12 час. однократно перед операцией) пациенту дают внутрь дозу 10-15 мг/кг, и далее такую же суточную дозу применяют последующие 1-2 нед. Позже дозу снижают до обычной поддерживающей (примерно 2-6 мг/кг).
Симптомами передозировки являются сонливость, сильная рвота, тахикардия, головные боли, развитие тяжёлой почечной недостаточности.
При приёме Циклоспорина необходимо следовать следующим мерам предосторожности. Терапию должны проводить в стационаре врачами, которые обладают большим опытом в лечении пациентов иммунодепрессантами. Нужно помнить, что вследствие приёма Циклоспорина предрасположенность к развитию злокачественных лимфопролиферативных опухолей возрастает. Именно поэтому нужно перед началом приёма решить, оправдывает ли положительный эффект от его лечения все сопряжённые с этим риски. При беременности препарат разрешается использовать лишь ввиду строгих показаний. Так как существует риск появления анафилактоидных реакций в результате внутривенного приёма, следует в целях профилактики принимать антигистаминные препараты, а также максимально быстро перевести пациента на пероральный способ введения лекарства.
Витамины
Если у больного наблюдаются кровотечения, помимо гемотерапии следует принимать 10% раствор хлористого кальция (внутрь), а также витамин К (в сутки по 15-20 мг). Кроме того, назначается аскорбиновая кислота в больших количествах (0,5-1 г/сут.) и витамин Р (в дозировке 0,15-0,3 г/сут.). Рекомендовано принимать фолиевую кислоту в больших дозах (максимум 200 мг/сут.), а также витамин В6, желательно в форме инъекций (по 50 мг пиридоксина ежедневно).
Физиотерапевтическое лечение
Чтобы активизировать работу костного мозга, применяется физиотерапевтическое лечение – диатермия трубчатых костей в области голеней либо грудины. Процедуру нужно проводить каждый день в течение 20 мин. Следует отметить, что этот вариант возможен только, если отсутствует выраженная кровоточивость.
Оперативное лечение
Пересадку костного мозга проводят в случае тяжёлой стадии аплазии. Результативность подобной операции повышается, если пациент находится в молодом возрасте, а также ему было выполнено малое количество переливаний элементов донорской крови (не больше 10-ти).
При таком лечении проводится извлечение у донора костного мозга и дальнейшая его пересадка реципиенту. Прежде, чем взвесь стволовых клеток будет введена, их обрабатывают при помощи цитостатиков.
ПККА по клиническим признакам и патофизиологическим механизмам во многом сходна с апластической анемией.
Эпидемиология
Встречаемость . Редко (имеются сообщения только о нескольких сотнях случаев).
Женщины предрасположены больше, чем мужчины - 2:1. Средний возраст начала болезни - около 60 лет.
Причины
Среди многочисленных причин развития цитопении чаще всего упоминается тимома. Несмотря на преобладание подобных сообщений, в действительности доля сопровождаемых тимомой ПККА, вероятно, низка. К другим причинам относятся злокачественные опухоли лимфоидной ткани, хронический миелоидный лейкоз (ХМЛ), миелодиспластический синдром, миелофиброз, сосудистые коллагенозы, беременность, паранеопластические синдромы, вирусы и действие лекарственных препаратов. Перечень лекарств, применение которых вызывает ПККА, сходен с таковым для АА, но более ограничен. Причинная связь между приемом дифенилгидантоина и возникновением ПККА была установлена после регистрации рецидива симптомов заболевания у пациента в результате повторного назначения данного препарата. Однако, как и при АА, большинство случаев ПККА являются идиопатическими.
Патофизиология
Наиболее понятен механизм селективной красноклеточной аплазии на фоне персистирующей инфекции парвовируса В 19 . Организм в состоянии хронической врожденной (синдром Незелоффа), ятрогенной (химиотерапия) или приобретенной (СПИД) иммунодепрессии не способен элиминировать цитотоксический вирус В 19 . Наличие тропности вируса к предшественникам эритроидного ряда приводит к селективному угнетению эритропоэза. Механизмы поражения костного мозга при ПККА, не связанных с В 19 , включают как гуморальную, так и клеточную иммунную элиминацию гемопоэтических клеток эритроидного ростка, находящихся на разных стадиях развития.
Диагностика
Отличительными для ПККА признаками являются анемия, ретикулоцитопения и изолированный дефицит эритробластов в костном мозге. Иногда в малых количествах обнаруживаются проэритробласты аномально гигантских размеров (пронормобласты с диаметром вдвое больше, чем у типичного пронормобласта, с наличием ядерных включений, цитоплазматических пузырьков или без них). Это подтверждает инфицирование парвовирусом В 19 . Лимфоциты распределяются/диффузно или образуют небольшие агрегаты. В отличие от апластической анемии общий цитоз не изменен.
Дополнительное обследование должно включать тестирование на наличие вируса В 19 , сероконверсию (по антителам класса IgM) и КТ средостения для обнаружения возможной тимомы.
Дифференциальный диагноз
- Наследственная ПККА: АДБ.
- Неиммунная гидроцефалия плода: внутриутробное инфицирование парвовирусом В 19 .
- Транзиторные синдромы:
- транзиторная детская эритробластопения (ТДЭ);
- транзиторный апластический гемолитический криз. У пациентов с гемолитической анемией при острой инфекции вирусом В 19 ретикулоцитопения способна возникнуть раньше, чем будет достигнут достаточный уровень вируснейтрализующих антител. Инфицирование здоровых лиц парвовирусом В 19 хотя и может вызвать преходящую ретикулоцитопению, редко привлекает внимание врачей, поскольку продолжительность циркуляции эритроцитов сравнима по времени с развитием адекватного иммунного ответа.
Лечение
Необходимо црекратить прием лекарств, воздействие которых увеличивает риск развития цитопении. При выявлении новообразований назначаются противоопухолевые средства с минимальными системными эффектами. Если ПККА сохраняется после исключения всех возможных этиологических факторов, проводится лечение, как при аутоиммунной ПККА.
Парвовирус В 19 . Эффективно назначение иммуноглобулинов внутривенно, поскольку они содержат нейтрализующие антитела.
Тимома . Проводится хирургическое лечение. Если оно безрезультатно, пациент должен получать терапию как при аутоиммунной ПККА.
Аутоиммунная ПККА . Назначается поэтапная иммуносупрессивная терапия до достижения ремиссии или до исчерпывания терапевтических возможностей. Лечение начинают с наиболее щадящих (низкотоксичных) режимов.
- Преднизолон.
- Азатиоприн или циклофосфамид (перорально) ± преднизолон; постепенно увеличивать дозы азатиоприна или циклофосфамида, до тех пор пока:
- количество ретикулоцитов не возрастет (ремиссия);
- количество лейкоцитов не снизится менее 2000/мкл;
- количество тромбоцитов не снизится менее 80 000/мкл.
- Антитимоцитарный глобулин + преднизолон; при отсутствии эффекта может быть назначен второй курс АТГ.
- Циклоспорин +преднизолон.
Стандартный курс терапии продолжается 4-8 недель. Самый ранний индикатор ответа - изменение количества ретикулоцитов. Должен проводиться тщательный мониторинг возможных токсических эффектов применяемых лекарственных средств, дозы которых после достижения ремиссии нужно медленно снижать до полной отмены. При рефрактерности пациента используют андрогены, плазмаферез, внутривенные препараты IgG, лимфоцитоферез и в конечном счете спленэктомию. Пациентам, зависимым от постоянных трансфузий эритроцитов, со временем потребуется проведение терапии хелатирующими препаратами (дефероксамин). Их начинают вводить после переливания приблизительно 50 доз.
Прогноз
В конце концов большинство пациентов становятся независимыми от трансфузий либо спонтанно (приблизительно 15 %), либо после иммуносупрессивной терапии. Впоследствии у 50 % пациентов развивается рецидив; из них около 80 % реагируют на второй курс иммуносупрессии. Средний срок выживания пациентов с приобретенной ПККА составляет 14 лет. Трансформация ПККА в другие заболевания, такие как апластическая анемия или лейкоз, происходит редко, однако в одном исследовании было зарегистрировано, что у 2 из 58 больных развился острый миелобластный лейкоз.