Семейная гиперхолестеринемия 2 а типа. Семейная гиперхолестеринемия – диагностические аспекты данного заболевания и методы лечения на современном этапе
Читайте также
Семейная гиперхолестеринемия
Семейная гиперхолестеринемия
(сокращенно СГ) - это генетическая болезнь, характеризующаяся высоким уровнем холестерина в крови, в частности, очень высоким уровнем липопротеидов низкой плотности (ЛПНП, т.н. "плохой холестерин"), а также ранним (в молодом возрасте) возникновением сердечно-сосудистых заболеваний. У многих пациентов происходят мутации в гене рецептора ЛПНП, кодирующего соответствующий белок ЛПНП-рецептора (обычно отвечающего за поглощение ЛПНП с кровотока) или аполипопротеина В (апо-В), который является частью ЛПНП, который связывается с рецептором (процесс, необходимый для связывания ЛПНП с рецептором). Мутации в других генах проявляются в относительно редких случаях. У пациентов, имеющих одну аномальную копию (гетерозиготная форма СГ) ЛПНПР гена сердечно-сосудистые заболевания могут возникать преждевременно (часто в возрасте от 30 до 40 лет). Наличие двух аномальных копий (гомозиготная форма СГ) может вызвать тяжелые сердечно-сосудистые заболевания даже у детей.
Гетерозиготная СГ является распространенным генетическим заболеванием, встречающимся в общей популяции в большинстве стран у 1:500 человек.Гомозиготная СГ проявляется намного реже и встречается в 1:1000000 новорожденных.
Гетерозиготную СГ, как правило, лечат статинами, секвестрантами желчных кислот или другими гиполипидемическими средствами, снижающими уровень холестерина. Обычно, первое обнаружение СГ у больных требует проведения генетической консультации. Гомозиготная СГ требует серьезного лечения, поскольку медикаментозная терапия часто не дает достаточного эффекта, и может требовать других видов лечения, включая аферез ЛПНП (удаление ЛПНП, данный метод имеет сходство с диализом или плазмоферезом) и, в отдельных случаях, трансплантацию печени.
Признаки и симптомы
Физикальные признаки
Обычно, высокий уровень холестерина, особенно в молодом возрасте, не вызывает никаких симптомов. Холестерин может откладываться в различных частях тела и может быть видимым снаружи, например, в желтоватых пятнах вокруг век (ксантелазма), на внешней границе радужной оболочки глаза (роговичная дуга) и в виде комков в сухожильях рук, локтей, коленей и стоп, особенно ахилловом сухожилии (ксантома сухожилия).
Изменения в системе кровообращения
Ускоренное отложение холестерина на стенках артерий приводит к атеросклерозу, который является основной причиной сердечно-сосудистых заболеваний. Самой распространенной проблемой при СГ является развитие ишемической болезни сердца (атеросклероз коронарных артерий, поставляющих сердце кровью) в более раннем возрасте, чем можно было бы ожидать в общей популяции. Это может привести к стенокардии (сжатие в груди при физической нагрузке) или сердечного приступа. Реже страдают артерии головного мозга, что может привести к транзиторной ишемической атаке (короткие эпизоды слабости в одной стороне тела или неспособность говорить), а иногда к ишемическому инсульту. Периферический облитерирующий эндартериит (закупорка артерий ног) происходит в основном у людей с СГ, которые курят, что может вызвать боль в икроножных мышцах при ходьбе, и во время отдыха (перемежающаяся хромота) и проблемы связанные с уменьшением кровоснабжения ног (например гангрена).
Если липиды начали проникать в аортальный клапан (клапан сердца между левым желудочком и аортой) или восходящую аорту (непосредственно над клапаном), утолщение стенок аорты может привести к сужению прохода, что называется аортальным стенозом. Надклапанный аортальный стеноз (отвердения аорты выше уровня аортального клапана) может проявляться более чем в половины гомозиготных пациентов, в то время как гетерозиготные реже бывают пораженными. Аортальный стеноз характеризуется одышкой, болями в груди, временными головокружениями или потерей сознания и часто симптомы напоминают стенокардию.
С возрастом увеличивается риск заболевания атеросклерозом и у тех, кто курит, имеет диабет, высокое кровяное давление и семейную историю сердечно-сосудистых заболеваний.
Диагностика
Измерение уровня липидов в крови
Уровень холестерина временами может быть установлен во время рутинного медицинского обследования для медицинского страхования или прохождения медосмотров при трудоустройстве. Врач может назначить исследование крови (развернутую липидограму) когда наблюдаются внешние физические признаки, такие как ксантелазма, ксантома, роговичная дуга, развиваются симптомы сердечно-сосудистых заболеваний или кто-то из членов семьи имел СГ. Результаты анализа, соответствующие гиперлипопротеинемии типа IIa соглано классификации Фредриксон, как правило, сопровождаются: повышенным уровнем общего холестерина, заметным повышением уровня липопротеидов низкой плотности (ЛПНП), нормальным уровнем липопротеидов высокой плотности (ЛПВП) и нормальным уровнем триглицеридов. ЛПНП, как правило, выше 95-ти процентилей, т.е. 95% здорового населения будет иметь более низкий уровень ЛПНП, хотя у больных с апо-В мутациями ЛПНП есть ниже этого уровня в 25% случаев. Уровень холестерина может быть значительно
выше у пациентов СГ, страдающих ожирением.
Анализ мутаций
В случае обнаружения изолированных высоких ЛПНП и клинических критериев (порой несколько отличаются в зависимости от страны), должны проводиться генетические тесты мутаций ЛПНП-рецепторов и апо-В мутаций. Мутации проявляются в 50 - 80% случаев, а те, не имеющие мутаций часто имеют более высокий уровень триглицеридов и в действительности могут иметь и другие причины для высокого уровня холестерина, такие как комбинированная гиперлипидемия в связи с метаболическим синдромом.
Дифференциальная диагностика
СГ необходимо отличать от семейной комбинированной гиперлипидемии и полигенных гиперхолестеринемий. Генетический скрининг в таком случае позволяет четко провести дифференциальную диагностику. Уровень липидов и наличие ксантом могут подтвердить диагноз. Ситостеролемия и церебротендинальный ксантоматоз - два редких состояния, которые могут также проявляться преждевременным атеросклерозом и ксантомами. Последнее состояние может также вызывать неврологические или психические проявления, катаракту, диарею и скелетные аномалии.
Генетика
Распространенным генетическим дефектом в СГ являются мутации ЛПНПР (встречаются в 1:500 случаях в зависимости от численности населения), апо-В мутации (встречаются в 1:1000), мутации гена PCSK9 встречаются менее чем в 1:2500 человек и ЛПНПРАБ1. Родственная болезнь ситостеролемия, которая имеет много общего с СГ и характерные особенности накопления холестерина в тканях, в связи с мутациями генов ABCG5 и ABCG8.
ЛПНП-рецептор
Схематическое описание белка ЛПНП-рецептора.
Ген ЛПНП-рецептора находится на коротком плече хромосомы 19 (19p13.1-13.3). Он состоит из 18 экзонов и охватывает 45 пар оснований, также белок продукта гена содержит 839 аминокислот в зрелой форме. Одна аномальная копия (гетерозиготная) СГ вызывает сердечно-сосудистое заболевание в возрасте от 50 лет примерно в 40% случаев. Наличие двух ненормальных копий (гомозиготы) приводит к ускорению появления атеросклероза в детстве включая вызванные им осложнения. Уровень ЛПНП в плазме обратно пропорционален активности ЛПНП-рецептора (ЛПНПР). В гомозиготах деятельность ЛПНПР составляет менее 2%, тогда как гетерозиготы имеют дефективную обработку ЛПНПР в пределах 2-25% в зависимости от характера мутаций. Известно более чем 1000 различных мутаций.
Есть пять основных классов СГ согласно ЛПНЩР мутаций:
. I класс: ЛПНПР вообще не синтезируется.
. II класс: ЛПНПР не транспортируется правильно с эндоплазматического ретикулума в аппарат Гольджи для выражения на поверхности клетки;
. III класс: ЛПНПР не связывают, надлежащим образом, ЛПНП на поверхности клетки в связи с дефектом в любом аполипопротеине B100 (R3500Q) или ЛПНП-Р);
. IV класс: ЛПНПР, граничащей с ЛПНП, должным образом, не собирается во впадинах покрытых клатрином для рецепторно-опосредованного эндоцитоза.
. V класс: ЛПНПР не возвращается на поверхность клетки.
Апо-В
Апо-В, в своей форме Apo-B100, является основным аполипротеином или белковой частью липопротеиновой доли. Его ген находится на второй хромосоме (2p24-p23) между 21,08 и 21,12 Mb длины. СГ часто связана с мутацией R3500Q, вызывающей замену аргинина глютамина в позиции 3500. Мутация расположена на части белка, который обычно сочетается с ЛПНП-рецептором, однако связывание нарушено в результате мутаций. Как и в случае с ЛПНПР, количество аномальных копий определяет тяжесть гиперхолестеринемии.
PCSK9
Мутации в гене белковой конвертазы субтилизина / кексина типа 9 (PCSK9) были связаны с аутосомно-доминантной (т.е. нужна только одна аномальная копия) СГ как было показано в 2003 году. Ген расположен на первой хромосоме (1p34.1-P32) и кодирует 666 аминокислот белка, который экспрессируется в печени. Было высказано мнение, что PCSK9 вызывает появление СГ в основном за счет сокращения числа ЛПНП рецепторов в клетках печени.
ЛПНЩРАБ1 (LDLRAP1)
Аномалии в гене ARH, также известном как ЛПНПРАБ1, были впервые описаны на примере одной семьи в 1973 году. В отличие от других причин, 2 мутантные копии гена являются необходимыми для развития СГ (аутосомно-рецессивный вид наследования). Мутации гена, как правило, вызывают синтез сокращенного белка. Реальная роль этого явления не вполне понятна, однако, очевидно, что она отыгрывает определенную функцию в связях между ЛПНП-рецепторами и углублениями покрытыми клатрином. Пациенты с аутосомно-рецессивной гиперхолестеринемией, как правило, имеют более тяжелые проявления болезни, чем гетерозиготы с мутациями ЛПНПР, но несколько легче, чем гомозиготы с мутациями гена ЛПНПР.
Патофизиология
Холестерин синтезируется в ферментативном метаболическом пути с привлечением HMG-КоА-редуктазы.
Холестерин-ЛПНП обычно циркулирует в организме в течение 2,5 дней, а затем соединяется с ЛПНП-рецептором в клетках печени, подвергаясь эндоцитозу, что приводит к усвоению. ЛПНП удаляется с кровотока, синтез холестерина в печени подавляется, за счет снижения активности HMG-КоА-редуктазного пути. В СГ функция ЛПНП-рецептора нарушается или является отсутствующей, а ЛПНП циркулируют со средней продолжительностью 4,5 дня, что приводит к значительному увеличению уровня холестерина-ЛПНП в крови с нормальным уровням других липопротеидов. Во время мутаций апо-В, пониженное сочетание частиц ЛПНП с рецептором приводит к повышению уровня холестерина ЛПНП. Сегодня точно не известно, как мутации PCSK9 и ARH вызывают дисфункцию ЛПНП-рецептора в мутации.
Хотя атеросклероз возникает в той или иной степени у всех людей, у пациентов с СГ он развивается ускоренно, в связи с избыточным уровнем ЛПНП. Степень тяжести развития атеросклероза зависит от количества ЛПНП-рецепторов, которые все еще остаются выраженными и степенью нарушения функции этих рецепторов. Во многих гетерозиготных пациентов с СГ, функция рецептора является лишь частично нарушенной и уровень ЛПНП остается относительно низким. В более серьезных гомозиготных формах, рецептор вообще не является выраженным.
Некоторые когортные исследования СГ позволяют предположить, что дополнительные факторы риска, как правило, играют существенную роль в развитии атеросклероза, когда у пациента есть ген СГ. В дополнение к классическим факторам риска, таких как: курение сигарет, высокое кровяное давление (артериальная гипертензия, АГ) и диабета, генетические исследования показали, что общие нарушения в гене протромбина (G20210A) увеличивают риск сердечнососудистых заболеваний у пациентов с СГ.
Несколько исследований показали, что высокий уровень аполипопротеина А был дополнительным фактором риска для развития ишемической болезни сердца. Повышений риск также был обнаружен у пациентов с особым генотипом ангиотензинпревращающего фермента (АПФ, англ. Angiotensin-converting enzyme ACE).
Тесты для выявление СГ
Хотя, экономически эффективным подходом для пациентов считается поиск случаев заболевания СГ среди членов семей, известны и другие предложенные стратегии, такие как общая проверка в возрасте от 16 лет. Последний подход может быть менее рентабельными в краткосрочной перспективе (5-10р), однако для долгосрочной перспективы такие исследования были бы чрезвычайно эффективными, ведь удалось бы обнаружить носителей соответствующих генов и заниматься ранней профилактикой заболевания.
Лечение
Гетерозиготна форма СГ
СГ, как правило, в стандартных ситуациях, лечится препаратами из группы статинов. Статины действуют путем ингибирования фермента С-гидрокси-3-метилглютарил-коэнзим-А редуктазы (ГМГ-КоА-редуктазы) в печени. Одновременно в печени образуется больше ЛПНП-рецепторов, которые способствуют удалению циркулирующих ЛПНП с кровотока. Статины эффективно снижают уровень холестерина и уровень ЛПНП, хотя иногда требуется дополнительное лечение другими лекарственными препаратами, например, секвестрантами желчных кислот (холестирамином или колестиполом), препаратами никотиновой кислоты или фибратами.
Необходим контроль и за другими факторами риска сердечнососудистых заболеваний, поскольку риск остается несколько повышенным, по сравнению с общей популяцией, даже если уровень холестерина контролируется. Специалисты рекомендуют, чтобы решения приняты насчёт лечения пациентов больных СГ с помощью статинов не базировались на обычных средствах прогнозирования риска (например, меры, предлагаемые исходя из Фремингемського исследования), поскольку они склонны недооценивать риск сердечнососудистых заболеваний у этой группы больных. В отличие от остального населения, СГ имеет высокий уровень холестерина от рождения, увеличивая риск возникновения болезни в семье. До введения статинов, клофибрат (старший препарат из группы фибратов, часто является причиной возникновение желчных камней), пробукол (особенно в случае образования больших ксантом) и тироксин, использовались для снижения уровня холестерина-ЛПНП.
Неоднозначным является использование эзетимиба, препятствующего абсорбции холестерина в кишечнике. Хотя он снижает уровень холестерина-ЛПНП, это не проявляется в улучшении маркера атеросклероза известного как утолщение комплекса интима-медиа. Следовательно, полученная польза от лечения эзетимибом при лечении СГ на сегодня является неизвестной.
На сегодняшний день нет интервенционных исследований, которые бы непосредственно показывали преимущества снижения смертности от уменьшения уровня холестерина у больных СГ. Скорее всего, преимущества становятся очевидными в зависимости от числа проведенных испытаний у людей, имеющих полигенную гиперхолестеринемию (в которой наследственность играет меньшую роль). Тем не менее, обсервационное исследование большого Британского реестра показали, что смертность у больных СГ начала несколько снижаться с начала 1990-х, когда были введены для лечения статины.
Гомозиготна форма СГ
Гомозиготна СГ труднее поддается лечению. ЛПНП-рецепторы функционируют минимально, если вообще действуют. Только высокие дозы статинов, часто в сочетании с другими препаратами являються умеренно эффективными для улучшения уровня липидов. Если с помощью медикаментозной терапии не удается снизить уровень холестерина, может быть использован аферез ЛПНП, то есть удаление ЛПНП из крови в процессе, который напоминает диализ. В очень тяжелых случаях может рассматриваться вопрос о трансплантации печени, это обеспечит печень нормальными действующими ЛПНП-рецепторами и приведет к быстрому улучшению уровня холестерина, но тогда увеличивается риск появления осложнений от самой трансплантации (таких, как реакция отторжения трансплантата, инфекция или негативное влияние от цитостатического лечения необходимого для прекращения реакции организма на трансплантат). Другие хирургические методы включают: частичное шунтирование подвздошной кишки, в которой часть тонкой кишки не участвует в всасывании питательных веществ, отсюда и холестерина, кроме того, портокавальный анастомоз, при котором воротную вену связывают с нижней полой веной, позволяющей крови с питательными веществами из кишечника обходить печень. Торможение микросомального белка трансфера триглицеридов, например, с помощью препарата AEGR-733, который на сегодня исследуется и вливания рекомбинантного человеческого белка аполипопротеина A1 исследуемого как вариант лечения. Генная терапия, предположительно, является будущей альтернативой в лечении.
Дети-пациенты
Учитывая, что СГ присутствует с рождения и атеросклеротические изменения могут начаться на раннем этапе жизни, иногда необходимо лечение молодых людей, или даже подростков с признаками сердечнососудистых заболеваний, которые у обычных людей должны проявиться в более зрелом возрасте. Для большей безопасности, многие врачи предпочитают использовать у детей секвестранты желчных кислот и фенофибраты, поскольку они лицензированы для детей. Тем не менее, статины представляются безопасными и эффективными, как для детей старшего возраста, так и для взрослых.
Междисциплинарная группа экспертов в 2006 году проинформировала, что раннее комбинированное лечение у детей с гомозиготной СГ с самым высоким риском должно осуществляться с помощью афереза ЛПНП, статинов и ингибиторов поглощения холестерина.
Эпидемиология
В большинстве исследуемого населения, гетерозиготная СГ встречается примерно в 1:500 людей, но не у всех проявляются соответствующие симптомы. Гомозиготная СГ встречается примерно в 1:1.000.000 случаев.
Мутации ЛПНПР чаще встречаются среди определенных групп населения, в связи с генетическим феноменом, известным как эффект основателя - они были основаны небольшой группой людей, один или несколько из которых были носителями мутаций. Африканеры, франко-канадцы, ливанские христиане и финны имеют высокие показатели особых мутаций, которые делают СГ слишком присущей этим группам. АпоВ мутации чаще встречаются в Центральной Европе.
История
Норвежский врач профессор К. Мюллер впервые связал физические признаки, высокий уровень холестерина и аутосомно-доминантное наследование в 1938 году. В начале 1970-х и 1980-х годов, генетическую причину СГ описал профессор Джозеф Л. Гольдштейн и профессор Майкл С. Браун в Далласе, штат Техас. Сначала, они обнаружили повышенную активность HMG-КоА-редуктазы, но исследования показали, что это не объясняет крайне аномальный уровень холестерина у пациентов с СГ.
Тогда, акцент был смещен в сторону объединения ЛПНП со своим рецептором, и последствия нарушенного сочетание при метаболизме, что оказалось основным механизмом СГ. Впоследствии многочисленные мутации в белке были непосредственно определены методом секвенирования. В 1985 году они получили Нобелевскую премию по медицине за открытие холестерина и метаболизма липопротеидов.
16943 0
Наследственная (семейная) гиперхолестеринемия – это генетическая проблема, которая связана с повышенным уровнем холестерина в крови и высоким риском сердечно-сосудистых заболеваний.
Лечение семейной гиперхолестеринемии включает диету, регулярные физические упражнения и прием профилактических препаратов, снижающих холестерин. Это заболевание также известно как семейная гиперлипидемия, гиперхолестеринемический ксантоматоз или мутация рецепторов ЛПНП.
Холестерин является естественным компонентом клеточных мембран. Он необходим для многих биохимических процессов в нашем организме, включая синтез гормонов. Холестерин мы получаем преимущественно из животной пищи. Некоторое количество холестерина вырабатывается нашей печенью.
Холестерин крови традиционно разделяют на «плохой» и «хороший». К «плохому» холестерину относятся липопротеины низкой плотности, или ЛПНП. Именно они отвечают за развитие атеросклероза – патологической закупорки артерий. Под «хорошим» холестерином подразумевают липопротеины высокой плотности (ЛПВП), которые держат уровень ЛПНП под контролем и способствуют снижению риска сердечно-сосудистых заболеваний.
Семейная гиперхолестеринемия – это наследственное заболевание, которое отвечает за 10% болезней коронарных артерий, возникающих в раннем возрасте, у активных людей моложе 55 лет. Причиной семейной гиперлипидемии является мутация гена, которая встречается у одного из 200-300 человек.
Факторы риска семейной гиперхолестеринемии включают:
История этого заболевания в семье.
Сердечные приступы в раннем возрасте у родственников.
Высокий уровень ЛПНП у одного или обоих родителей, особенно если он устойчивый к медикаментозной терапии.
Проявления болезни
Высокий уровень холестерина в крови сам по себе не вызывает никаких симптомов. Человек даже не догадывается о своей проблеме, пока не сдаст анализы крови.Симптомы этого заболевания могут быть следующими:
Высокий уровень холестерина в крови пациента
Холестериновые отложения на коленях, локтях и ягодицах – ксантомы .
Боль в груди, вызванная сужением коронарных сосудов – стенокардия.
Инфаркты, которые случаются в относительно раннем возрасте.
Механизм семейной гиперхолестеринемии
Холестерин доставляется к клеткам с током крови. Молекулы ЛПНП прикрепляются к особым клеточным рецепторам, будучи как бы созданными для них (по принципу «ключ к замку»). Благодаря наличию этих рецепторов холестерин проникает в клетки и выполняет свои природные функции.Ген в 19-й хромосоме, называемый LDLR-геном, кодирует эти клеточные рецепторы. При семейной гиперхолестеринемии у больных наследуется мутация LDLR-гена, которая нарушает развитие холестериновых рецепторов, их количество и структуру. Это означает, что ЛПНП недостаточно хорошо усваиваются клетками, оставаясь в свободном виде в кровотоке. Высокий уровень ЛПНП в крови приводит к развитию атеросклероза – основной причины инфарктов и других тяжелых заболеваний.
Наследование семейной гиперхолестеринемии
Семейная гиперхолестеринемия – это так называемое аутосомно-доминантное заболевание. В большом количестве случаев дефектный ген наследуется от одного носителя; в редких случаях носителями являются оба родителя.1. Дефектный ген у одного из родителей.
Если один из родителей является носителем одного нормального и одного дефектного гена в паре, то каждый ребенок имеет 50% вероятность наследования одного мутировавшего гена. Риск развития заболеваний коронарных сосудов в раннем возрасте зависит от возраста и пола больного ребенка:
У 50% мужчин с этим заболеванием болезни коронарных артерий развиваются до того, как они достигают 50-летнего возраста.
Все 100% мужчин, рожденных от носителя семейной гиперлипидемии, будут страдать коронарными заболевания к 70 годам.
Примерно у 85% таких мужчин может случиться инфаркт миокарда до достижения ими 60-летнего возраста.
У 12% женщин, наследовавших эту мутацию, возникнут заболевания коронарных артерий до 50-летнего возраста. Около 74% из них будут страдать коронарными заболеваниями к 70 годам.
2. Дефектный ген у обоих родителей.
В этом случае прогноз более пессимистичный – каждый четвертый ребенок (25%) наследует сразу два дефектных гена в паре. При этом у ребенка развиваются тяжелые коронарные заболевания в первые десятилетия жизни, даже в детском возрасте. Эта форма семейной гиперхолестеринемии устойчива к лечению. Несмотря на все меры, риск сердечного приступа остается очень высоким. У больных может наблюдаться интенсивное отложение избыточного холестерина под кожей – многочисленные ксантомы на коленях, локтях, ягодицах.
Диагностика заболевания
Диагноз семейной гиперхолестеринемии устанавливается по результатам многих тестов, среди которых:Физический осмотр.
Анализы крови на холестерин.
Исследование сердца (стресс-тест) .
Генетический анализ для подтверждения.
Лечение семейной гиперхолестеринемии
Поскольку это заболевание наследственное, то полного излечения от него нет. Терапия направлена на снижение риска заболеваний коронарных артерий и инфаркта.Изменение рациона. Больным настоятельно рекомендуется уменьшить потребление продуктов, которые содержат холестерин и насыщенные жиры. Также полезно есть больше клетчатки – свежие фрукты, овощи. После 3-4 месяцев такой диеты врач проводит повторные анализы, чтобы определиться с дальнейшими мерами. В любом случае, диета – это важнейшая составляющая лечения!
Растительные стеролы и станолы. Эти вещества по структуре похожи на холестерин, но они не усваиваются клетками организма. Исследования показали, что употребление стеролов и станолов приводит к снижению уровня холестерина в крови. Источниками этих веществ являются кукуруза, рис, орехи, растительные масла.
Упражнения. Регулярные физические упражнения способствуют снижению уровня холестерина, что подтверждается многочисленными исследованиями.
Контроль массы тела. Ожирение – это очень существенный фактор риска. Поддержание нормального индекса массы тела (ИМТ) – это одна из основных целей терапии. Кроме снижения риска атеросклероза, борьба с ожирением поможет уменьшить вероятность сахарного диабета и других заболеваний.
Отказ от курения. Токсичные компоненты табака инициируют первичное повреждение сосудов, с которых начинается атеросклероз и постепенная закупорка артерий.
Медикаментозная терапия. У весьма небольшого процента больных семейной гиперлипидемией получается снизить свой холестерин без лекарств. В подавляющем большинстве случаев больным нужен постоянный прием специальных препаратов, таких как статины (аторвастатин, симвастатин, ловастатин).
Другие методы лечения: аферез ЛПНП, представляющий собой очищение крови от липопротеинов через специальный аппарат.
Этиология и встречаемость семейной . Семейная гиперхолестеринемия (MIM №143890) - аутосомно-доминантное заболевание метаболизма холестерина и липидов, вызываемое мутациями в гене LDLR. Семейная гиперхолестеринемия встречается во всех расах и имеет распространение 1 на 500 в большинстве европеоидных популяций. Это составляет чуть меньше 5% всех пациентов с гиперхолестеринемией.
Патогенез семейной гиперхолестеринемии
Рецептор ЛПНП , трансмембранный гликопротеид, преимущественно экспрессирующийся в печени и коре надпочечников, играет ключевую роль в гомеостазе холестерина. Он связывает аполипопротеин В-100, единственный белок ЛПНП, и АроЕ, белок ЛПОНП, липопротеинов средней плотности, остатков хиломикронов и некоторых ЛПВП. Рецепторы ЛПНП печени захватывают из кровотока приблизительно 50% липопротеинов промежуточной плотности и 66-80% низкой плотности за счет эндоцитоза; остаток захватывается недостаточно изученным путем, не зависящим от рецептора ЛПНП.
Мутации , связываемые с семейной гиперхолестеринемией, наблюдают в гене LDLR; от 2 до 10% таких мутаций - большие инсерции, делеции или перестройки, вызванные рекомбинацией между повторами Alu в пределах гена LDLR. Некоторые мутации - доминантные. Большинство мутаций достаточно редкие, хотя некоторые популяции - например, ливанцы, французские канадцы, южноафриканские индийцы, южноафриканские евреи ашкенази и африканеры (жители ЮАР голландского происхождения) имеют общие мутации и высокое распространение болезни из-за эффекта родоначальника.
Гомозиготные или гетерозиготные мутации в гене LDLR уменьшают эффективность эндоцитоза ЛПНП и липопротеинов средней плотности и вызывают накопление ЛПНП плазмы за счет увеличения их синтеза из липопротеинов средней плотности и уменьшения печеночного захвата. Высокий уровень ЛПНП в плазме вызывает атеросклероз, увеличивая захват ЛПНП через рецептор-независимые пути, например эндоцитоз окисленных ЛПНП макрофагами и гистиоцитами.
Моноциты , проникающие через интиму артерий и захватывающие ЛПНП, образуют пенистые клетки и выбрасывают цитокины, вызывающие пролиферацию гладкомышечных клеток артериальной стенки. Первоначально гладкомышечные клетки производят достаточно коллагена и матричного белка, чтобы сформировать над пенистыми клетками волокнистый колпачок; но, поскольку пенистые клетки продолжают эндоцитоз окисленных ЛПНП, в конечном счете, они прорываются через колпачок в просвет артерии и инициируют образование тромба. Такое образование тромба - основная причина инсультов и инфарктов миокарда.
Окружающая среда , пол и генетический фон модифицируют эффект мутаций рецептора ЛПНП на их уровень в плазме, и тем самым частоту возникновения атеросклероза. Основной средовой модификатор уровня ЛПНП в плазме - диета; в Тунисе большинство гетерозигот по семейной гиперхолестеринемии имеют уровень ЛПНП в диапазоне «нормы» для жителей США и редко страдают сердечно-сосудистыми болезнями и ксантомами.
Аналогично китайские гетерозиготы по семейной гиперхолестеринемии, проживая в Китае, редко имеют ксантомы и сердечно-сосудистую патологию, тогда как китайцы, гетерозиготы по семейной гиперхолестеринемии, проживающие в западных странах, имеют клинические проявления, сходные с гетерозиготами по семейной гиперхолестеринемии европейского происхождения. Пищевой холестерин подавляет синтез рецепторов ЛПНП и тем самым поднимает уровень ЛПНП в плазме; этот эффект усиливается насыщенными жирными кислотами, например пальмитиновой (из молочных продуктов), и ослабляется ненасыщенными жирными кислотой, например олеиновой и линолевой.
Поскольку аналогичная диета неодинаково поднимает уровень ЛПНП среди разных пациентов, на метаболизм ЛПНП также должны влиять и другие средовые и генетические факторы. Некоторые семьи с семейной гиперхолестеринемией передают другой доминантный локус, уменьшающий уровень ЛПНП в плазме, что подтверждает наличие генетического модификатора.
Фенотип и развитие семейной гиперхолестеринемии
Гиперхолестеринемия , самый ранний симптом при семейной гиперхолестеринемии, обычно появляется уже при рождении и остается единственным клиническим симптомом в первом десятилетии жизни у гетерозиготных пациентов; во всех возрастных периодах концентрация холестерина в плазме выше 95-го процентиля у более чем 95% пациентов. «Старческая» дуга роговицы и ксантомы сухожилий начинают появляться к концу второго десятилетия жизни, к моменту смерти уже 80% гетерозигот по семейной гиперхолестеринемии имеют ксантомы. Почти 40% взрослых пациентов имеют рецидивирующие непрогрессирующие полиартриты и тендосиновиты.
Подсчитано, что развитие ИБС среди гетерозигот по семейной гиперхолестеринемии зависит от возраста и пола. Чаще всего при отсутствии лечения концентрация холестерина превышает 300 мг/дл.
Гомозиготная форма семейной гиперхолестеринемии проявляется ксантомами сухожилий и дугой роговицы уже на первом десятилетии жизни. Без энергичного лечения гомозиготная семейная гиперхолестеринемия обычно летальна к возрасту 30 лет. Концентрация холестерина без лечения колеблется между 600 и 1000 мг/дл.
Особенности проявлений семейной гиперхолестеринемии
:
Возраст начала: для гетерозигот - молодость или средний возраст; для гомозигот - детство
Гиперхолестеринемия
Атеросклероз
Ксантомы
Старческая дуга
Лечение семейной гиперхолестеринемии
Повышение холестерина ЛПНП плазмы крови и наличие в семейном анамнезе гиперхолестеринемии, ксантом или ранней ИБС заставляет предположить диагноз семейной гиперхолестеринемии. Тем не менее подтвердить диагноз трудно, поскольку для этого нужно определить функции рецептора ЛПНП в фибробластах кожи или мутации в гене LDLR. В большинстве популяций большое количество мутаций в гене LDLR затрудняет прямой анализ ДНК, если не подозревается конкретная мутация.
Тем не менее отсутствие ДНК-подтверждения не создает помех для оказания помощи пациентам с семейной гиперхолестеринемией, поскольку окончательный молекулярный диагноз не дает прогностической или терапевтической информации, в основном зависящей от семейного анамнеза и уровня холестерина в плазме.
Независимо от того, семейная это гиперхолестеринемия или нет, все пациенты с повышенным уровнем холестерина ЛПНП требуют энергичных мер по нормализации концентрации для уменьшения риска ИБС. Тщательная нормализация уровня холестерина может предохранить и обратить развитие атеросклероза. Гетерозиготам по семейной гиперхолестеринемии необходимо строжайшее соблюдение высокоуглеводной диеты с резким уменьшением потребления жиров, обычно приводящей к 10-20% снижению уровня холестерина ЛПНП.
Поскольку такого уменьшения обычно недостаточно, пациентам также назначают лечение одним из трех классов лекAPCтвенных средств (или их комбинацией): секвестрантами желчных кислот, статинами (ингибиторы 3-гидрокси-3-метилглутарил КоА редуктазы) и никотиновой кислотой. Текущие рекомендации - начало лекарственной терапии в 10-летнем возрасте у пациентов с концентрацией холестерина ЛПНП выше 190 мг/дл и отрицательным семейным анамнезом по ранней ИБС, и для пациентов с уровнем холестерина ЛПНП выше 160 мг/ дл с положительным семейным анамнезом.
У гомозигот по семейной гиперхолестеринемии уровень холестерина плазмы можно уменьшить до 70% с помощью плазмафереза. Терапевтическая эффективность плазмафереза повышается, если его проводить на фоне энергичной терапии статинами и никотиновой кислотой. В редких случаях проводят пересадку печени.
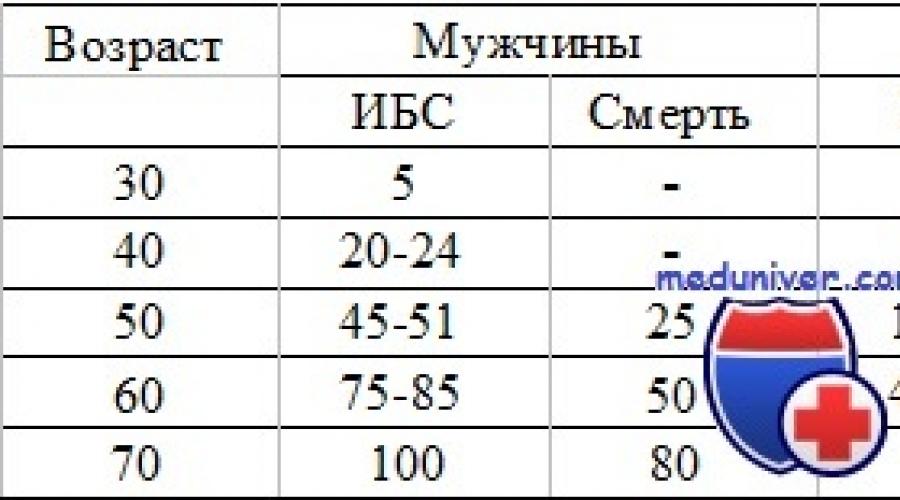
Показатели зависимости ИБС и смерти от возраста и пола (в %) у гетерозигот по семейной гиперхолестеринемии
Риски наследования семейной гиперхолестеринемии
Поскольку - аутосомно-доминантное заболевание, каждый ребенок больного родителя имеет 50% шанс унаследовать мутантный аллель гена LDLR. Без лечения гетерозиготы по семейной гиперхолестеринемии имеют 100% риск развития ИБС к 70 годам для мужчин и 75% риска для женщин. Постоянное лечение заметно уменьшает этот риск, нормализуя концентрацию холестерина в плазме.
Пример семейной гиперхолестеринемии . У Л.Л., ранее здорового 45-летнего французского канадца, произошел инфаркт миокарда. У него была небольшая ксантома в ахилловом сухожилии справа. У его брата также была ИБС; его мать, бабушка по матери и два дяди по матери умерли от осложнений ИБС. Кроме семейного анамнеза и пола, факторы риска по ИБС и атеросклерозу для Л.Л. включали повышенный уровень ЛПНП, небольшое ожирение, малую физическую активность и курение. На основе семейного анамнеза заподозрена аутосомно-доминантная форма гиперхолестеринемии.
Семейная гиперхолестеринемия: скрининг, диагностика и лечение детей и взрослых пациентов: клиническое руководство, подготовленное группой экспертов по семейной гиперхолестеринемии при Национальной липидной ассоциации США
(Familial hypercholesterolemia: screening, diagnosis and management of pediatric and adult patients: clinical guidance from the National Lipid Association Expert Panel on Familial Hypercholesterolemia)
Goldberg A.C., Hopkins P.N., Toth P.P., Ballantyne C.M., Rader DJ., Robinson J.G., Daniels S.R., Gidding S.S., de Ferranti S.D., Ito M.K., McGowan M.P., Moriarty P.M., Cromwell WC., Ross J.L., Ziajka P.E.; National Lipid Association Expert Panel on Familial Hypercholesterolemia
Перевод с английского ГАКоновалов
Абстракт
Семейные гиперхолестеринемии (СГ) представляют собой группу генетических дефектов, привоШ дящих к выраженному повышению концентрации холестерина в крови и повышенному риску ранШ него развития ишемической болезни сердца. СГ входит в число наиболее распространенных врожШ денных метаболических нарушений. Для достижения заданного снижения холестерина ЛПНП на 50% и более необходима агрессивная терапия, направленная на снижение уровня липидов. При наШ личии у больных СГ других факторов риска может потребоваться уменьшение холестерина ЛППП до еще более низкого заданного уровня. Несмотря на распространенность этого заболевания и доШ ступность эффективных методов лечения, СГ часто остается недиагностированной и нелеченШ ной, особенно у детей. Недостаточно эффективные диагностика и лечение СГ свидетельствуют о необходимости существенного улучшения информированности и понимания этого заболевания, как в обществе, так и среди медицинских работников. В документе содержатся рекомендации по проведению скрининга, диагностики и лечения СГ у детей и взрослых, разработанные группой эксШ пертов по семейной гиперлипидемии при Национальной липидной ассоциации США. Данное сообщеШ ние содержит конкретные клинические инструкции для врачей первичной медикоШанитарной поШ мощи и специалистов по липидам с целью улучшения ведения больных СГ и снижения повышенного у них риска ИБС.
Ключевые слова: семейная гиперхолестеринемия; рецептор ЛПНП; аферез; каскадный скрининг; гетерозигота; гомозигота.
Вступление
Семейные гиперхолестеринемии (СГ) представляют собой группу генетических дефектов, приводящих к выраженному повышению концентрации холестерина в крови. Хотя ранее термин СГ использовали исключительно для обозначения дефектов рецептора ЛПНП (ЛПНП-Р), в настоящем документе будет использоваться более широкое определение, отражающее открытие дефектов, затрагивающих гены аполипопротеина (Апо) В, субтилизи-на/кексина пропротеинконвертазы типа 9 (РСБК9) и других дефектов, которые вызывают тяжелую ги-
перхолестеринемию и повышают риск раннего развития ишемической болезни сердца (ИБС). У больных, гетерозиготных по СГ (наследующих генетический дефект от одного из родителей), концентрации общего холестерина, как правило, составляют от 350 до 550 мг/дл, а у гомозиготных больных (наследующих генетические дефекты от обоих родителей) - от 650 до 1000 мг/дл. СГ входит в число наиболее распространенных врожденных метаболических нарушений. Во многих популяциях гетерозиготная форма встречается приблизительно у одного из 300-500 человек. Гомозиготная форма встречается достаточно редко, приблизительно
у 1 из 1 000 000 человек. Поскольку СГ обусловлена генетическим дефектом, гиперхолестеринемия присутствует с детского возраста и приводит к раннему развитию ИБС. Особенное внимание вызывают гомозиготы по СГ, у которых тяжесть гиперхоле-стеринемии обычно приводит к тяжелому атеросклерозу и даже патологии сердечно-сосудистой системы в детском и подростковом возрасте.
Для достижения заданного снижения холестерина ЛПНП на 50 % и более необходима агрессивная терапия, направленная на снижение уровня липидов. При наличии у больных СГ других факторов риска может потребоваться уменьшение холестерина ЛПНП до еще более низкого заданного уровня. В дополнение к соблюдению диеты и изменению образа жизни, существуют эффективные и безопасные методы медикаментозного лечения, включающие статины и другие гиполипидемиче-ские средства, а также аферез ЛПНП (метод удаления ЛПНП и других Апо В-частиц из крови). Несмотря на широкую распространенность этого заболевания и доступность эффективных методов лечения, СГ часто остается недиагностированной и нелеченной, особенно у детей. Согласно некоторым оценкам, СГ диагностирована приблизительно у 20 % больных, и лишь очень немногим из них проводится надлежащее лечение.
Недостаточно эффективные диагностика и лечение СГ свидетельствуют о необходимости существенного улучшения информированности и понимания этого заболевания, как в обществе, так и среди медицинских работников. Центральное место в обучении занимает понимание важности скрининга в детском возрасте и каскадного скрининга на содержание липидов у родственников больных СГ В данном документе представлены рекомендации по проведению скрининга, диагностики и лечения СГ у детей и взрослых (в том числе, женщин с сохраненной репродуктивной способностью и беременных женщин), разработанные группой экспертов по семейной гиперлипидемии при Национальной липидной ассоциации США. Данное сообщение содержит конкретные клинические инструкции для врачей первичной медико-санитарной помощи и специалистов по липидам с целью улучшения ведения больных СГ и снижения повышенного у них риска ИБС.
1. Определение, распространенность,
генетика, диагностика и скрининг
1.1. Определение
семейных гиперхолестеринемий
1.1.1. Семейные гиперхолестеринемии (СГ) представляют собой группу генетических дефектов, приводящих к выраженному повышению концентрации холестерина в крови.
1.1.2. В целях данного документа, термин СГ применяется по отношению к аутосомным доминантным формам тяжелой гиепрхолестеринемии,
если не указано иначе. Однако причины наследственного высокого содержания холестерина не ограничиваются аутосомной доминантной СГ
1.2. Распространенность СГ и риск, связанный с СГ
1.2.1. С учетом того, что во многих популяциях СГ страдает 1 из 300-500 человек, СГ является одним из наиболее распространенных серьезных генетических нарушений.
1.2.2. В настоящее время в США проживает приблизительно 620 000 больных СГ
1.2.3. Для больных с нелеченной СГ риск раннего развития ИБС повышен приблизительно 20-кратно, по сравнению с риском для общей популяции.
1.2.4. Приблизительно 1 из 1 000 000 человек является гомозиготой или составной гетерозиготой по мутации рецептора ЛПНП и страдает исключительно тяжелой гиперхолестеринемией, которая в отсутствие лечения быстро приводит к атеросклерозу.
1.2.5. В некоторых популяциях (например, канадцев французского происхождения и жителей Южной Африки голландского происхождения) распространенность СГ может достигать 1:100.
1.3. Генетика СГ
1.3.1. В настоящее время известные причины СГ включают мутации генов, кодирующих рецепторы ЛПНП (Ш1_К; ЛПНП-Р), АпоВ (АРОВ), или суб-тилизина/кексина пропротеинконвертазы типа 9 (РСБК9).
1.3.2. Известно более 1600 мутаций гена Ш1_К, вызывающих СГ, и этими мутациями обусловлено приблизительно 85%-90% всех случаев СГ
1.3.3. В Северно-европейских популяциях наиболее распространенной причиной гиперхолестеринемии, вызванной мутацией гена АРОВ, является мутация Агд3500в!п гена АРОВ, которой обусловлено от 5% до 10% случаев СГ (в других популяциях встречается редко).
1.3.4. Мутациями, в результате которых продукт экспрессии мутантного гена РСБК9 приобретает новые и патологические функции, в большинстве исследований было вызвано менее 5% случаев СГ
1.4. Скрининг,
направленный на выявление СГ
1.4.1. Рекомендуется проводить скрининг, направленный на выявление повышенного содержания холестерина. У пациента следует предположить СГ в тех случаях, когда при отсутствии лечения измеренное натощак содержание холестерина-ЛПНП или холестерина-не-ЛПВП соответствует указанным уровням или превышает их:
Взрослые (старше 20 лет): содержание холестерина-ЛПНП >190 мг/дл или холестерина-не-ЛПВП >220 мг/дл;
Дети, подростки и молодые совершеннолетние (моложе 20 лет):
1.4.2. У всех лиц с такими результатами определения холестерина следует собрать семейный анамнез, т.е. данные о высоком содержании холестерина и заболеваниях сердца у ближайших родственников (первой степени родства). Для лиц с гиперхолестеринемией или ранним развитием ИБС (начало заболевания у мужчин моложе 55 лет и женщин моложе 65 лет) в семейном анамнезе риск СГ повышен.
1.4.3. Для детей с повышенным содержанием холестерина или ранним возникновением патологии сердечно-сосудистой системы в анамнезе решение о скрининге на содержание холестерина следует принимать уже по достижении ими 2-летнего возраста. Скрининг должен быть проведен всем лицам, достигшим 20 лет.
1.4.4. Хотя перечисленные ниже результаты физикального обследования обнаруживаются не у всех больных СГ, для практикующего врача такие данные являются серьезным основанием для того, чтобы предположить у пациента СГ и определить содержание необходимых параметров липидного спектра, если такие данные отсутствуют:
Ксантомы сухожилия в любом возрасте (чаще всего встречаются в ахилловом сухожилии и сухожилиях мышцы-разгибателя пальца, но могут затрагивать также сухожилия колена и трицепса).
Липоидная дуга роговицы у пациента моложе 45 лет.
Туберозные ксантомы или ксантелазма у пациента моложе 20-25 лет. При указанных выше концентрациях холестерина-ЛПНП вероятность СГ при проведении скрининга общей популяции составляет приблизительно 80 %. Указанные ниже концентрации холестерина-ЛПНП являются для клинического врача серьезным основанием для рассмотрения СГ в качестве диагноза и сбора дополнительной информации о родственниках:
1.5. Диагностика
1.5.1. В семейном анамнезе особенно важно отметить возраст, с которого пациент страдает ИБС.
1.5.2. Физикальные симптомы СГ малочувствительны, но могут быть достаточно специфичными. Для того чтобы обнаружить ксантомы сухожилия следует выполнить тщательную пальпацию (не ограничиваясь осмотром) ахиллова сухожилия и сухожилий мышц-разгибателей пальцев. Липо-идная дуга роговицы (частичная или полная) ука-
зывает на СГ, если пациент моложе 45 лет. Ни ксантелазма, ни туберозная ксантома не являются специфичными для СГ, но если они обнаруживаются у молодого пациента, следует учитывать возможность СГ Важно отметить, что отсутствие какого-либо из перечисленных данных физикального обследования не исключает наличия СГ у пациента.
1.5.3. Для формальной клинической диагностики СГ может быть использован один из нескольких наборов критериев (проведенное в США исследование МБОРБЭ - «Проведите раннюю диагностику, чтобы предотвратить раннюю смерть», Голландская сеть клиник по лечению липидных нарушений, Реестр Саймана-Брума). Следует отметить, что концентрации холестерина-ЛПНП варьируют в зависимости от возраста.
1.5.4. Клинический диагноз СГ наиболее вероятен при обнаружении двух или более родственников первой степени родства с повышенным содержанием холестерина, попадающим в указанный интервал; при выявлении повышенного содержания холестерина у детей в семье; и в случае обнаружения ксантомы сухожилия у пациента или его близкого родственника.
1.5.5. После того как в семье диагностирована СГ, для идентификации других членов семьи, страдающих этим заболеванием, могут применяться несколько более низкие контрольные концентрации холестерина-ЛПНП.
1.5.6. Эпизодически у пациентов с СГ отмечается повышенное содержание триглицеридов, причем повышенное содержание триглицеридов не исключает диагноза СГ
1.6. Генетический скрининг
1.6.1. Генетический скрининг на СГ, в целом, не является необходимым для диагностики или лечения пациента, но может быть полезен при неопределенном диагнозе.
1.6.2. Для некоторых пациентов идентификация мутации, вызвавшей СГ, может служить дополнительной мотивацией для проведения необходимого лечения.
1.6.3. Отрицательный результат генетического теста не исключает СГ, поскольку приблизительно у 20% пациентов с клинически определенной СГ мутации не обнаруживаются, несмотря на тщательный поиск с использованием современных методов.
1.7. Каскадный скрининг
1.7.1. Каскадный скрининг включает определение содержания липидов у всех ближайших родственников (первой степени родства) больных с диагностированной СГ
1.7.2. По мере проведения каскадного скрининга выявляются новые случаи СГ, для родственников которых также следует рассмотреть целесообразность скрининга.
1.7.3. Каскадный скрининг - наиболее целесообразный способ обнаружения больных с ранее
не диагностированной СГ, который также является экономически целесообразным с точки зрения затрат на год сохраненной жизни. В популяции в целом, с точки зрения затрат на год сохраненнойжиз-ни, столь же эффективен скрининг в популяции молодых людей (моложе 16 лет), при условии назначения гиполипидемической терапии всем пациентам с идентифицированной СГ
2.1. Обоснование лечения
2.1.1. Для лиц с СГ в течение всей жизни существует очень высокий риск ИБС и очень высокий риск раннего начала ИБС.
2.1.2. Раннее начало лечения является крайне благоприятным. Долгосрочная медикаментозная терапия позволяет существенно снизить пожизненный риск ИБС, обусловленный генетическим нарушением, и снизить у больных с СГ частоту нежелательных событий, связанных с ИБС.
2.1.3. Больные СГ нуждаются в лечении в течение всей жизни и регулярном последующем наблюдении.
2.2. Лечение
2.2.1. Дети и взрослые с содержанием холестерина-ЛПНП >190 09=уп/1мг/дл [или холестерина-не-ЛПВП >220 мг/дл] после изменения образа жизни нуждаются в медикаментозной терапии.
2.2.2. Лечение взрослых (старше 20 лет) больных СГ должно быть направлено на снижение содержания холестерина-ЛПНП на >50%.
2.2.3. В качестве стартовой терапии взрослым больным СГ следует назначить статины.
2.3. Интенсивная медикаментозная терапия
2.3.1. Больным с повышенным риском может потребоваться интенсифицировать медикаментозную терапию для достижения более существенных целей (снижения содержания холестерина-ЛПНП до уровня <190 мг/дл и холестерина-не-ЛПВП до уровня <130 мг/дл).
2.3.2. Повышенный риск ИБС у больных СГ может быть обусловлен любым из следующих факторов: наличием клинически явной ИБС или другого атеросклеротического сердечно-сосудистого заболевания, сахарного диабета, ИБС с очень ранним началом в семейном анамнезе (<45 лет у мужчин и <55 лет у женщин), курение в настоящее время, наличие двух или более факторов риска ИБС и высокое содержание липопротеина (а) > 50 мг/дл по данным нечувствительного к изоформам анализа.
2.3.3. В случае отсутствия у больных СГ перечисленных выше характеристик вопрос об интенсификации медикаментозной терапии может быть рассмотрен, если содержание холестерина-ЛПНП сохраняется на уровне >160 мг/дл (или холестерина-не-ЛПВП >190 мг/дл), либо при не-
возможности достичь начального снижения содержания холестерина-ЛПНП на 50%.
2.3.4. В целях интенсификации терапии или при лечении больных с непереносимостью статинов целесообразно назначить эзетемиб, ниацин и препараты, способствующие выведению желчных кислот.
2.3.5. Ожидаемую пользу назначенной пациенту комбинированной лекарственной терапии следует сопоставить с повышением стоимости лечения, потенциальными побочными эффектами такой терапии и ухудшением соблюдения пациентом режима и схемы лечения.
2.4. Необходимо
энергично устранять факторы риска
2.4.1. Для больных СГ и представителей общей популяции факторы риска одинаковы и требуют энергичного устранения, при этом особое внимание следует уделить отказу от курения.
2.4.2. Необходимо подчеркнуть важность регулярной двигательной активности, здорового питания и контроля над массой тела.
2.4.3. Необходимо проводить лечение, направленное на снижение артериального давления до уровня <140/90 мм рт. ст. (в случае сахарного диабета - до уровня <130/80 мм рт. ст.). Лицам с высоким риском ИБС или инсульта следует рассмотреть целесообразность приема низких доз аспирина (75-81) мг/сутки.
2.5. Не следует использовать алгоритмы
стратификации риска
2.5.1. Риск ИБС повышен для всех больных СГ Ни один из традиционных методов оценки риска не позволяет рассчитать 10-летний риск ИБС для больных СГ Поэтому оценку 10-летнего риска проводить не рекомендуется.
2.5.2. Всем больным СГ необходимо уделить внимание образу жизни.
2.6. Решение вопроса о направлении пациента клипидологу
2.6.1. Если концентрацию холестерина-ЛПНП не удается снизить на >50% или пациент относится к группе высокого риска, целесообразно решить вопрос о направлении пациента к липидологу с опытом лечения больных СГ
2.6.2. Лицам с СГ следует предложить провести каскадное тестирование родственников первой степени.
3. Вопросы ведения педиатрических
пациентов
3.1. Скрининг
3.1.1. Для выявления всех детей с СГ в возрасте 9-11 лет рекомендуется проводить всеобщий скрининг, включающий определение липидного спектра натощак или измерение холестерина-не-ЛПВП после приема пищи. В этом возрасте можно
идентифицировать пациентов на стадии потенциального возникновения прогрессирующего атеросклероза.
3.1.2. Если после приема пищи концентрации холестерина-не-ЛПВП превышают 145 мг/дл, следует определить липидный спектр натощак.
3.1.3. При наличии случаев гиперхолестерине-мии или раннего начала ИБС в семейном анамнезе, или при наличии других важных факторов риска ИБС скрининг следует проводить раньше (после достижения 2-летнего возраста).
3.1.4. Идентификация СГ у лиц с другими важными факторами риска ИБС имеет критическое значение для стратификации риска.
3.1.5. Необходимо выполнить оценку возможных дополнительных причин дислипидемии (посредством анализа анамнеза, физикального обследования, проведения определенных лабораторных исследований). Дополнительные причины включают гипотиреоз, нефротический синдром и заболевания печени.
3.2. Диагностика
3.2.1. При измерении натощак концентрации липидов, позволяющие предположить СГ у детей, подростков и совершеннолетних людей моложе 20 лет, не получающих лечения, составляют >160 мг/дл (холестерин-ЛПНП) или >190 мг/дл (холестерин-не-ЛПВП). Эти значения подтверждаются исследованиями с участием семей больных СГ
3.2.2. Второе определение липидного спектра следует выполнить для того, чтобы оценить реакцию пациента на изменение характера питания и точно классифицировать пациентов с содержанием липидов, близким к классификационным пороговым значениям.
3.3. Липидологи
3.3.1. Ответственность за скрининг и диагностику должна быть возложена на врачей первичной медико-санитарной помощи.
3.3.2. Для лечения детей с СГ рекомендуется консультация или направление к липидологу. К педиатрическим специалистам-липидологам относятся детские кардиологи, эндокринологи и другие медицинские специалисты, прошедшие специальное обучение липидологии. В настоящее время применение гиполипидемических препаратов, в большинстве случаев, не входит в подготовку педиатров.
3.3.3. Лечение гомозиготных больных СГ всегда должен проводить специалист-липидолог.
3.4. Оценка риска сердечно-сосудистых
осложнений
3.4.1. Принципиальное значение имеет всесторонняя оценка риска и лечение ИБС [включая измерение содержания липопротеина (а)]. Присутствие многочисленных факторов риска ИБС сопровождается резким ускорением развития атеросклероза.
3.4.2. Первичная профилактика, включающая консультирование, направленное на предотвращение развития риска (отказ от курения, диета с низким содержанием насыщенных жиров, надлежащая калорийность пищи и регулярная физическая активность, способствующая профилактике сахарного диабета) является важным компонентом лечения больных СГ
3.5. Лечение детей
3.5.1. При лечении детей после перехода на диету и решения вопроса о физической активности в качестве стартового фармакологического лечения наиболее предпочтительными являются статины.
3.5.2. Следует стремиться к началу лечения в возрасте 8 лет или старше. В отдельных случаях, например, при гомозиготной СГ, может потребоваться начать лечение в более раннем возрасте.
3.5.3. Клинические исследования со среднесрочной продолжительностью последующего наблюдения свидетельствуют об эффективности и безопасности применения статинов в лечении детей.
3.5.4. Цель гиполипидемической терапии детей с СГ заключается в снижении содержания холестерина-ЛПНП более чем на 50% или до уровня ниже 130 мг/дл. При лечении СГ у детей необходимо найти оптимальное сочетание между увеличением доз, сопровождающимся потенциальными побочными эффектами, с одной стороны, и достижением целевых значений, с другой стороны. В лечении пациентов с дополнительными факторами риска ИБС следует устанавливать более жесткие целевые значения холестерина-ЛПНП.
3.6. Гомозиготная СГ
3.6.1. При гомозиготной СГ начало лечения в раннем возрасте и постоянный мониторинг имеют жизненно важное значение.
3.6.2. Для некоторых гомозиготных больных СГ могут оказаться эффективными высокие дозы ста-тинов, но большинство больных нуждаются в афе-резе ЛПНП. В некоторых клиниках также проводится трансплантация печени.
3.6.3. Новым методом лечения является генная терапия, которая может быть особенно полезной для гомозиготных больных СГ
4. Вопросы лечения взрослых
4.1. Изменение образа жизни
4.1.1. Пациентам с СГ необходима консультация по вопросам изменения образца жизни.
■ Терапевтические изменения образа жизни и вспомогательные меры в области питания
Сниженное потребление насыщенных жиров и холестерина: Общее содержание жиров в потребляемой калорийности должно составлять 25-35%; содержание насыщенных жирных кислот <7% от потребляемой
калорийности; содержание холестерина пищевого происхождения <200 мг/сутки.
Применение растительных сложных эфиров станола или стерола: 2 г/сутки.
Потребление растворимой клетчатки 10-20 г/сутки.
■ Физическая активность и потребляемая калорийность должны обеспечивать достижение и поддержание здоровой массы тела.
■ Ограничение потребления алкоголя.
4.1.2. Необходимо поощрять врачей за направление больных к зарегистрированным диетологам или другим квалифицированным специалистам по вопросам питания для проведения пищевой терапии.
4.2. Медикаментозное лечение СГ
4.2.1. При лечении взрослых больных СГ стартовая терапия включает применение средних или высоких доз высокоактивных статинов, дозу которых подбирают таким образом, чтобы достичь снижения содержания холестерина-ЛПНП на 50% по сравнению с исходным уровнем. Для больных с СГ применение статинов с низкой активностью, как правило, оказывается недостаточным.
4.2.2. При непереносимости статина, назначенного в качестве стартовой терапии, следует решить вопрос о переходе на альтернативный статин или применение статинов через день.
4.2.3. При противопоказаниях к проведению стартовой терапии статинами или плохой переносимости такой терапии, может быть рассмотрен вопрос о целесообразности применения эзетимиба, препаратов, способствующих выведению желчных кислот (колесевелам), или ниацина.
4.2.4. Большинству пациентов, которым нельзя применять статин, потребуется комбинированная медикаментозная терапия.
4.3. Дополнительные вопросы лечения
4.3.1. Если в лечении больного не ставится цель снижения холестерина-ЛПНП максимально возможной и переносимой дозой статина, следует назначить комбинированную терапию, включающую эзетимиб, ниацин или препарат, способствующий выведению желчных кислот (предпочтительно колесевелам).
4.3.2. Выбор дополнительных лекарственных комбинаций должен основываться на оценке сопутствующих факторов риска миопатии, сопутствующей терапии, наличии других заболеваний и нарушений уровня липидов.
4.4. Кандидаты на проведение афереза ЛПНП
4.4.1. Аферез ЛПНП является методом, одобренным Управлением США по надзору над качеством пищевых продуктов, косметических средств
и медикаментов (FDA) для лечения больных, не являющихся кандидатами на проведение медикаментозной терапии, направленной на снижение холестерина-ЛПНП или больных, у которых имеются симптоматические заболевания.
4.4.2. Больным, у которых после 6-месячного лечения не отмечается адекватной реакции на медикаментозную терапию в максимально переносимых дозах, показано проведение афереза ЛПНП в соответствии со следующими инструкциями:
Функционально гомозиготные больные СГ
Функционально гетерозиготные больные СГ с содержанием холестерина-ЛПНП >300 мг/ дл (или холестерин-не-ЛПВП >330 мг/дл)
и наличием не более чем 1 фактора риска.
Функционально гетерозиготные больные СГ с содержанием холестерина-ЛПНП >200 мг/дл (или холестерин-не-ЛПВП >230 мг/дл), принадлежащие к группе высокого риска, т.е. с 2 факторами риска или высоким содержанием липопротеина (a)
>50 мг/дл, определенным при использовании нечувствительного к изоформам анализа.
Функционально гетерозиготные больные СГ с содержанием холестерина-ЛПНП >160 мг/дл (или холестерин-не-ЛПВП >190 мг/дл), принадлежащие к группе очень высокого риска (больные хронической ИБС, другими сердечно-сосудистыми заболеваниями или сахарным диабетом).
на проведение афереза ЛПНП
4.5.1. Медицинские работники должны направлять кандидатов на проведение афереза ЛПНП в сертифицированные клиники. Также возможно самостоятельное посещение пациентами этих клиник. Список клиник, сертифицированных для проведения афереза ЛПНП, находится в процессе разработки и будет размещен на сайте Национальной липидной ассоциации (www.lipid.org).
4.6. Женщины с сохраненной репродуктивной способностью
4.6.1. Женщины с СГ перед беременностью должны получить инструкции по отмене лечения статинами, эзетимибом и ниацином не позднее, чем за 4 недели до прекращения предохранения от беременности и не должны применять эти лекарственные препараты в период беременности и лактации.
4.6.3. В случае незапланированной беременности женщине с СГ следует немедленно прервать лечение статинами, эзетимибом и ниацином и срочно проконсультироваться с лечащим врачом.
4.7. Методы лечения
в период беременности
4.7.1. Статины, эзетимиб и ниацин противопоказаны беременным женщинам. Может быть рассмотрен вопрос о целесообразности применения других гиполипидемических препаратов (например, колесевелама) под наблюдением лечащего врача.
4.7.2. При наличии значимого атеросклероза или если пациентка является гомозиготой по СГ следует решить вопрос о проведении афереза ЛПНП в период беременности.
4.8. Сложные в лечении пациенты
4.8.1. Если применение других методов лечения оказывается недостаточным, либо больной с СГ не переносит фармакотерапию или аферез ЛПНП, могут быть использованы другие методы лечения, включая шунтирование подвздошной кишки и трансплантацию печени (оба метода используются редко) и, потенциально, новые лекарственные препараты, которые разрабатываются в настоящее время.
5. Проблемы в будущем, государственная
политики и осведомленность общества
5.1. Скрининг
5.1.1. Проведение скрининга детей на гипер-холестеринемию и начало лечения больных с СГ и тяжелой гиперхолестеринемией является обязанностью всех сотрудников первичной медикосанитарной помощи и компетентных специалистов.
5.2. Специалисты в области липидологии
5.2.1. Больных СГ с непереносимостью стартовой терапии статинами и больных, у которых не наблюдается достаточной реакции на такую терапию, следует направлять к специалисту-липидологу.
5.2.3. Пациентов, которые являются кандидатами на проведение более интенсивной терапии, и пациентов с ранним началом ИБС в семейном анамнезе (ранее 45 лет у мужчин и ранее 55 лет у женщин) также следует направлять к липидологу.
5.3. Страховая медицина
5.3.1. Для пациентов с СГ в течение всей жизни существует высокий риск атеросклеротических сердечно-сосудистых заболеваний, и они нуждаются в надлежащей терапии.
5.3.2. Страховая медицина должна покрывать расходы на начальный скрининг, стартовую терапию надлежащими лекарственными препаратами и контроль за реакцией на лечение.
5.3.3. Страховая медицина должна покрывать расходы на надлежащие лекарственные препараты, включая высокоактивные статины и комбинированную гиполипидемическую терапию. Страховая ме-
дицина также должна распространяться на другие лекарственные препараты и комбинированную терапию пациентов с непереносимостью статинов.
5.3.4. Страховая медицина должна покрывать расходы на аферез ЛПНП и генетическое обследование, если применение этих методов необходимо.
5.4. Осведомленность общества и поставщиков медицинских услуг
5.4.1. Следует использовать разнообразные методы для пропаганды ранней диагностики и профилактики СГ, профилактики и лечения ИБС.
5.4.2. Необходимо повышать информированность поставщиков медицинских услуг посредством обучения их на всех уровнях, посредством партнерских отношений с профессиональными организациями, местными, национальными и международными органами.
5.5. Ответственность за обучение
5.5.1. Системы здравоохранения, больницы, компании по управлению фармацевтическими пособиями и страховые компании должны способствовать обучению пациентов и поставщиков медицинских услуг
5.5.2. Правительственные организации и другие высокопоставленные должностные лица должны объединить усилия,направленные на проведение скрининга и лечения СГ
5.6. Необходимость научных исследований.
5.6.1. Ниже перечислены вопросы, имеющие
отношение к СГ, для ответа на которые необходимы дальнейшие исследования:
Препараты, обеспечивающие дополнительное снижение концентрации холестерина-ЛПНП;
Способы, стимулирующие соблюдение режима лечения и длительное лечение;
Рентабельные методы генетического скриннга;
Формирование правильного поведения больных СГ;
Анализ экономической эффективности различных подходов к скринингу и лечению;
Анализ экономической эффективности преимуществ интенсивной терапии;
Долгосрочное последующее наблюдение за больными СГ, включающее наблюдение за безопасностью долгосрочной терапии гиполипидемическими препаратами;
Различие метаболизма лекарственных препаратов в зависимости от пола, этнической принадлежности и возраста;
Отдаленные благоприятные эффекты комбинированной терапии в отношении сердечно-сосудистой системы;
Лечение СГ в период беременности;
Механизмы и устранение непереносимости статинов;
Безопасность и эффективность пищевых добавок и вспомогательных пищевых продуктов для снижения содержания холестерина ЛПНП;
5.7. Финансирование
5.7.1. Финансирование образовательной и исследовательской деятельности должно осуществляться из многочисленных источников, включая правительственные, профессиональные, коммерческие медицинские и фармацевтические ассоциации, частные источники финансирования.
Заключение
Семейная гиперхолестеринемия - сложное, но поддающееся лечению заболевание. Врачам первичной медико-санитарной помощи должно быть известно о своей ключевой роли в раннем об-
наружении и лечении СГ и о доступности дополнительной поддержки и руководства со стороны специалистов-липидологов, которые прошли интенсивную подготовку в сфере лечения нарушений в содержании липидов. Основные элементы контроля над СГ включают снижение концентрации холестерина ЛПНП, устранение дополнительных факторов риска ИБС, таких как повышенное артериальное давление и курение, стимуляция соблюдения схемы длительного лечения, включающего изменение образа жизни и фармакотерапию. Скрининг родственников первой степени, включая братьев, сестер, родителей и детей пациентов СГ, способствует раннему обнаружению и лечению. Долгосрочная терапия больных СГ значительно снижает или устраняет избыточный риск возникновения ИБС, сохраняющийся в течение всей жизни больного, снижая тем самым риск в общей популяции.
Список литературы.
1. Hopkins PN, Toth PP, Ballantyne CM. Rader DJ. Семейные гиперхолестеринемии: распространенность, генетика и рекомендации по диагностике и скринингу, разработанные группой экспертов по семейной гиперхолестеринемии при Национальной липидной ассоциации CWA.J Clin Lipidol. 2011 ;5(3 suppl):S9PS17.
2. RobinsonJG, GoldbergAC. Лечение взрослых больных семейной гиперхолестеринемией и обоснование лечения: рекомендации группы экспертов по семейной гиперхолестеринемии при Национальной липидной ассоциации США. J Clin Lipidol. 2011;5(3 suppl):S18PS29.
3. Daniels SR, Gidding SS, de Ferranti SD. Педиатрические аспекты семейной гиперхолестеринемии:рекомендации группы экспертов по семейной гиперхолестеринемии при Национальной липидной ассоциации США. J Clin Lipidol. 2011;5(3 suppl):S30PS37.
4. Ito MK, McGowan MP, Moriarty PM. Лечение семейной гиперхолестеринемии у взрослых: рекомендации группы экспертов по семейной гиперхолестеринемии при Национальной липидной ассоциации США. J Clin Lipidol. 2011;5(3 suppl):S38PS45.
5. GoldbergAC. RobinsonJG, Cromwell WC. Ross JL. Ziajka PE. Семейные гиперхолестеринемии - проблемы в будущем, государственная политики и осведомленность общества: рекомендации группы экспертов по семейной гиперхолестеринемии при Национальной липидной ассоциации США./ Clin Lipidol. 2011:5(3 suppl) S46PS51.
(СГХС) – наследственная патология, характеризующаяся выраженным повышением количества липопротеинов низкой плотности (ЛПНП) в кровотоке и высоким риском раннего развития ишемической болезни сердца. В большинстве случаев протекает бессимптомно. Иногда отмечается боль в груди, волдыри на руках, коленях и вокруг глаз, сухожильные и подкожные отложения холестерина. Основные методы диагностики – сбор наследственного анамнеза, анализ крови на общий холестерин и ЛПНП. Для лечения используется гиполипидемическая диета, регулярные физические нагрузки, медикаментозная коррекция липидоснижающими препаратами, аферез атерогенных липопротеидов.
МКБ-10
E78.0 Чистая гиперхолестеринемия

Общие сведения
Синонимы семейной гиперхолестеринемии – первичная, наследственная гиперхолестеринемия. Является не самостоятельным заболеванием, а состоянием предрасположенности к сердечно-сосудистым болезням – атеросклерозу сосудов , ИБС , острому инфаркту миокарда . Данные о распространенности СГХС имеют большой разброс, поскольку во многих случаях патология остается недиагностированной. Частота гетерозиготной формы, при которой у пациента имеется один дефектный ген из пары, составляет 1 случай на 108-300 человек. Гомозиготная форма, характеризующаяся наличием двух мутационных генов в аллели, протекает тяжелее и встречается гораздо реже – у 1 человека из 1 миллиона. Среди всех вариантов гиперхолестеринемии на долю семейной ГХС приходится 10% случаев.

Причины
СГХС является наследственной аутосомно-доминантной патологией, которая вызывается мутацией генов, ответственных за метаболизм ЛПНП и активность их рецепторов. При наличии одного дефектного гена в паре возникает гетерозиготная гиперхолестеринемия – легкое и умеренное нарушение метаболизма липидов. В редких случаях у пациентов присутствует два парных измененных гена (от матери и от отца), развивается гомозиготная гиперхолестеринемия – тяжелое расстройство липидного обмена со злокачественным течением. Причиной семейной гиперхолестеринемии является мутация в одном из следующих генов:
- LDLR . Ген задает функциональность ЛПНП-рецептора, расположенного, в основном, на поверхности клеток печени. При мутации его активность снижается, процесс связывания и выведения из кровотока циркулирующих липопротеидов нарушается. Выявлено более 1600 видов мутаций гена LDLR. Их доля в общем количестве СГХС составляет 85-90%.
- APOB . Дефект гена приводит к изменению структуры аполипопротеина B100, входящего в состав ЛПНП, обеспечивающего их связывание с рецептором. Мутационные изменения APOB имеются у 5-10% больных наследственной гиперхолестеринемией. Они провоцируют менее выраженное повышение ЛПНП, чем мутации LDLR.
- PCSK9. Этот ген кодирует фермент пропротеиновую конвертазу субтилизин-кексинового типа 9, которая усиливает разрушение ЛПНП-рецепторов. Мутации в гене PCSK9 увеличивают активность фермента, в результате чего количество рецепторов уменьшается. Патология такого типа встречается в 5% случаев СГХС.
Патогенез
В основе семейной гиперхолестеринемии лежит генетически обусловленное повышение уровня ЛПНП. Чаще всего оно вызывается снижением активности специфического рецептора, ответственного за выведение липопротеинов. ЛПНП – наиболее атерогенные частицы. Атеросклеротические бляшки формируются при их накоплении в субэндотелиальном пространстве. Чем выше уровень липопротеинов с низкой плотностью в крови, тем интенсивнее протекает процесс.
Хуже всего ЛПНП выводятся у людей с гомозиготной первичной гиперхолестеринемией: оба парных гена имеют мутацию, функциональность рецептора снижена на более чем на 50%, концентрация ЛПНП высокая, плохо поддается коррекции при помощи медикаментов и диеты. Атеросклероз и его осложнения развиваются в детском и подростковом возрасте. При гиперхолестеринемии гетерозиготного типа только один ген дефектный, половина или более рецепторов остаются функциональными, количество ЛПНП повышается, но долгое время не проявляется клинически. Зачастую первым признаком СГХС становится атеросклероз, ишемическая болезнь сердца или инфаркт миокарда.
Симптомы
СГСХ развивается с рождения, но часто не имеет выраженных клинических признаков. Диагноз устанавливается с опозданием при манифестации сердечно-сосудистых заболеваний, таких как ИБС, инфаркт сердечной мышцы, атеросклероз. Симптомы гиперхолестеринемии наблюдаются менее чем у половины больных. Примерно у трети пациентов формируются сухожильные ксантомы – уплотнения из жироподобного вещества (холестерина), прощупываемые над сухожилиями. Узелки особенно легко определяются на кистях. Холестерин откладывается под кожей век, возле глаз в виде ксантелазм – желтоватых или не имеющих специфического цвета плоских узелков.
Патогномоничный признак СГСХ – липоидная дуга роговицы. Она представляет собой скопления холестерина по краю роговицы, которые обнаруживаются при офтальмологическом осмотре и выглядят как белый или серо-белый ободок. В отдельных случаях больные отмечают боль и дискомфорт в области груди, водянистые высыпания на коже рук, локтей и коленей. На стадии развития атеросклероза выявляются мозаичные симптомы поражения внутренних органов.
Осложнения
При отсутствии лечения гомозиготная первичная гиперхолестеринемия способствует развитию атеросклероза до 20-летнего возраста, продолжительность жизни больных не превышает 30 лет. Нелеченые пациенты с гетерозиготной формой патологии имеют высокий риск развития ИБС, к 60 годам диагноз подтверждается у 85,5% мужчин и у 53% женщин. Средние показатели продолжительности жизни для мужчин составляют 53 года, для женщин – 62 года. ИБС становится причиной смерти половины мужчин с наследственной гетерозиготной гиперхолестеринемией. Около 20% случаев инфаркта миокарда до 45 лет связаны с наличием СГХС.
Диагностика
Обследованием пациентов занимаются терапевт , кардиолог , врач-генетик . Важным этапом диагностики является сбор личного и семейного анамнеза. Учитывается возраст больного и время начала симптомов, потому что для наследственной патологии характерен ранний дебют. В пользу диагноза семейной гиперхолестеринемии рассматривается наличие двух и более близких родственников (особенно детей) с повышенным холестерином крови, ксантомами и/или липоидными дугами роговиц. Основная задача дифференциальной диагностики – исключение вторичной гиперхолестеринемии. Обследование больных проводится следующими методами:
- Физикальный осмотр. При тщательной пальпации сухожилий стоп, голеней и кистей обнаруживаются ксантомы. На роговице определяется наличие полной или частичной липоидной дуги, у лиц моложе 45-48 лет она указывает на СГХС. Отсутствие ксантом, ксантелазм и роговичной дуги не исключает наличия гиперхолестеринемии.
- Липидограмма. Комплексное лабораторное исследование липидного профиля является наиболее информативным методом диагностики. Показатель общего холестерина при гетерозиготной патологии составляет 7,5-14 ммоль/л, при гомозиготной – 14-26 ммоль/л. Уровень ЛПНП соответственно повышается до 3,3-4,9 ммоль/л и до 4,15-6,5 ммоль/л.
- Генетический скрининг. Выявление мутаций и их характера необходимо при невозможности подтвердить диагноз другими способами, а также для составления оптимального плана лечения. У 80% пациентов обнаруживаются дефекты в генах LDLR, APOB или PCSK9. У оставшихся 20% генетические изменения не диагностируются даже при развернутых симптомах СГХС.
Лечение семейной гиперхолестеринемии
Терапия включает комплекс мероприятий, нацеленных на снижение количества ЛПНП. Тактика определяется формой гиперхолестеринемии, величиной отклонения показателей липидограммы от нормы, выраженностью симптомов и возрастом пациента. Значительная часть лечебных процедур проводится амбулаторно при регулярном контроле эффективности лечащим врачом. Пациентам назначается:
- Медикаментозная терапия. Применяются препараты, понижающие уровень липидов в плазме крови. Наиболее целесообразен комбинированный прием статинов, фибратов, секвестрантов желчных кислот и ингибиторов абсорбции холестерина в кишечнике.
- Коррекция образа жизни. Исключаются все факторы риска гиперлипидемии: требуется полный отказ от курения, контроль артериального давления, нормализация массы тела, регулярная физическая нагрузка. Диетотерапия основана на ограничении количества насыщенных жиров и трансжиров. Ежедневное поступление холестерина с пищей – не более 200 мг.
- Аферез ЛПНП. При гомозиготном типе гиперхолестеринемии медикаментозное лечение зачастую оказывается недостаточно результативным. Проводятся процедуры удаления липопротеинов из крови. Аферез также может быть показан больным ИБС и атеросклерозом с СГХС гетерозиготной формы, особенно если прием лекарств не дает ожидаемого положительного эффекта.
- Стимуляция ЛПНП-рецепторов. С недавних пор в медицинскую практику внедряется патогенетическая терапия СГХС. Используется препарат, стимулирующий увеличение количества рецепторов ЛПНП в клетках печени. В итоге усиливается захват и выведение из организма липопротеинов.
Прогноз и профилактика
Благоприятное течение семейной гиперхолестеринемии наиболее вероятно при гетерозиготном типе, раннем начале лечения и периодическом контроле уровня холестерина на протяжении всей жизни. Из-за наследственного характера патологии предупредить ее развитие невозможно. Профилактические меры нацелены на раннюю диагностику гиперхолестеринемии, что позволяет сократить вероятность атеросклероза, ИБС, инфаркта мышцы сердца. Для этого проводится каскадный скрининг – исследование уровня липидов крови у всех ближайших родственников пациента.